Pathologie: Entzündliche ZNS-Erkrankungen
Buch-Navigation
Liquordiagnostik
BearbeitenLiquordiagnostik
- Normwerte: Zellzahl 4/μl, Eiweiß < 50 mg/dl, Lactat < 2,2 mmol/l, Glucose 60 % des gleichzeitig bestimmten Blutzuckers.
- Reiber-Schema: Hinweise für intrathekale Immunglobulin-Synthese und/oder Störung der Blutliquorschranke.
- Isoelektrische Fokussierung (IEF): Elektrophoretische Auftrennung von Proteinen nach ihrer Ladung.
- Makroskopische Beurteilung: Farbe (klar, Blut, Trübung)
- Mikroskopie: Zellen, Bakterien, Pilze.
Meningitis
BearbeitenEntzündung der Hirnhäute.
Ät.:
- Bakterien (s.u.)
- Viren (Enteroviren, Mumps, Masern, HSV, VZV, CMV, FSME)
- Pilze
Liquor:
- Bakteriell: > 1000 Zellen/μl , überwiegend Granulozyten, Eiweiß und Laktat stark erhöht, Glucose < 40 % des gleichzeitig bestimmten Blutzuckers.
- Viral: Liquor: 10 - 500 Zellen/μl, mehr Lymphozyten als Granulozyten, Eiweiß und Laktat normal oder leicht erhöht, Glucose normal. Erregernachweis: AK-Nachweis frühestens nach 8 Tagen, PCR (ev. Wdh.).
Subduraler Abzess / Empyem
BearbeitenÄt: Infektion des Subduralen Raumes, mit Adhäsion: Abzess, bei Ausbreitung mit Verlegung: Empyem
Ep: 20% aller intrakraniellen Infektionen, meist Streptokokken
Pg: meist direkte Ausbreitung in die Dura (Mastoid, Innenohr), seltener venös aus Sinus frontalis oder Sinus ethmoidalis
Makro: Eiter, der sich von der Hirnoberfläche abwischen lässt
Prg: Mortalität 10-20%, unbehandelt in der Regel fatal
Enzephalitis / Enzephalomeyelitis / Myelitis
BearbeitenEinteilung der Enzephalitiden nach Ausbreitungstyp.
Meningoenzephalitis
BearbeitenEitrige Leptomeningitis (Haubenmeningitis)
BearbeitenSyn: Akute bakterielle Meningitis, purulente Leptomeningitis
Ät.: Die häufigsten Erreger sind Streptococcus agalactiae (bes. Neugeborene, Säuglinge), Escherichia coli (Neugeborene), Haemophilus influenzae (seltener wg. Impfung, alle Altersstufen), Neisseria meningitidis (Kinder bis junge Erwachsene am häufigsten), Streptococcus pneumoniae (alle Alterstufen), Listeria monocytogenes (Neugeborene, Alte, Immunsuprimierte).
Infektionswege: Per continuitatem (Mastoiditis), hämatogen (arteriell, venös (z.B. Eiterherde im Gesicht)), Liquorfistel nach Schädelbasisfraktur.
Makro: Eitrig getrübte Meningen, bei Listeriose unter Immunsupression: Hyperämie, Kongestion, kaum Eiter.
Mikro: Massenhaft segmentkernige Granulozyten, paravasal Fibrinfäden, Ödem, Hyperämie.
Liquor: Starke Pleozytose > 1000 Zellen/μl (v.a. Granulozyten), Eiweiß und Laktat stark vermehrt, Glucose < 40 % des gleichzeitig bestimmten Blutzuckers. Erregernachweis.
Klinik:
- Meningitis: Kopfschmerzen, Meningismus.
- Enzephalitis: Quantitative (Vigilanzminderung) und qualitative Bewußtseinsstörungen, fokal-neurologische Symptome, Krämpfe.
- Begleitbefunde: Herpes labialis.
Kompl.: Hirnödem, Pyocephalon (Eiter in den inneren und äußeren Liquorräumen), Abszedierung, Hydrocephalus occlusus oder malresorptivus, Vaskulitis mit aseptischer Entzündung, septische Sinusthrombose, Innenohrschwerhörigkeit, Sepsis mit disseminierter intravasaler Gerinnung (DIC, Waterhouse-Friedrichsen-Syndrom), MOV.
Th.: Antibiotika.
Proph.: Impfungen sind verfügbar gegen Meningokokken (Serotypen A, C, W135 und Y), Pneumokokken und Haemophilus influenzae.
Prg.: Let. früher 80 %, heute 20 %.
 |
 |
Tuberkulöse Meningitis (basale Meningitis)
BearbeitenEp.: Bes. Kinder, Alte, Immungeschwächte, Menschen aus Risikogebieten.
Pg.: Streuung einer Tuberkulose vom Ort der Infektion, meist Lungentuberkulose.
Makro: Basale Menigitis (milchige Trübung).
Mikro: HEUBNER'sche Endarteriitis, Granulome, Nachweis von säurefesten Stäbchen.
Liquor: Geringe Pleozytose, stark erhöhter Eiweißgehalt, verringerter Glucosegehalt.
Klinik: Kopfschmerzen, Abgeschlagenheit, subfebrile Temperaturen, Hirnnervenausfälle (z.B. Abduzensparese), subfebrile Temperaturen.
DD: Kryptokokken
Meldepflicht: Behandlungsbedürftige Erkrankung und Tod, Behandlungsabbruch.
Literatur: Mackert BM, Conradi J, Loddenkemper C, et al.. “[Neurotuberculosis: a continuing clinical challenge]”. Nervenarzt, 79:153–66, February 2008. DOI:10.1007/s00115-007-2322-0. PMID 17673961.
 |
Spirochäten-Infektionen
BearbeitenÜbersicht Spirochäten (Gram negative, zum Teil human-pathogene Bakterien)
Neuroborreliose
BearbeitenMeningoradikulitis, Meningopolyneuritis BANNWARTH, Lyme-Borreliose
Ät.: Borrelia burgdorfferi (Überträger: Zecken)
Klinik: Nächtliche radikuläre Rückenschmerzen, Paresen, Myositiden, Neuritiden
Histo: Epineurial gelegenes mononukläres Infiltrat, Neuronenverlust mit axonaler Degneration
Siehe auch unter Mikrobielle Hauterkrankungen.
Neurosyphillis
BearbeitenÄt: Treponema pallidum
Tertiärstadium der Syphillis
- Tabes dorsalis - Entzündung und Degeneration der Hinterstränge des Rückenmarks.
- Progressive Paralyse - Frontal betonte Meningoenzephalitis mit psychiatrischen und neurologischen Symptomen.
 |
 |
Metastatische Herdenzephalitis
BearbeitenÄt.: Bakterielle Mikrothromben (bakt. Endokarditis, Sepsis, Septikopyämie).
Hirnabszess(e)
Bearbeiten
Def.: Umschriebene gegen die Umgebung abgegrenzte entzündliche Gewebseinschmelzung im Hirnparenchym.
Ep: Häufigste infektiöse Raumforderung
Ät.: Bakterien, Parasiten, Pilze, RF Immunsuppresion.
Pg.:
- Metastatische Einschwemmung (s.o.) meist aus eitrigen Lungenprozessen, aber auch z.B. bei Endokarditis, Sepsis.
- Übergreifen von HNO-Infektionen (Sinusitis, Otitis media, Mastoiditis) auf das Gehirn.
- Eintritt über Liquorfisteln z.B. nach Schädelbasisfraktur, postoperativ, Fremdkörper-assoziiert (externe Ventrikeldrainage (EVD), VA-Shunt, VP-Shunt).
Makro: Einzelne oder multiple abgekapselte Herde mit flüssigem trüb-eitrigem Inhalt. Meist an der Rinden-Mark-Grenze lokalisiert.
Mikro: Erste 3 Tage Cerebritis, danach zentrale Nekrose mit Zelltrümmer, zerfallende neutrophile Granulozyten, Makrophagen, Beginn der Kapselbildung nach 10-13 Tagenaus Granulationsgewebe mit Lymphozyten, Plasmazellen, Monozyten und Makrophagen. Ausbildung einer Kapselwand mit Fibroblasten und Kapillaren.
Prg: Mortaliät 5-20%, bei intraventrikulärer Ruptur einer Kapsel bis zu 80%
Virale Enzephalitiden
BearbeitenBefallsmuster:
- leptomeningeal (aseptische Meningitis): Echo- Coxackieviren, HSV-2, Mumps, HIV
- Polioenzephalitis/myelitis: Polio, Coxackie, Rabies, Arbo-, Echo- und Enteroviren
- Leukoenzephalitis/melitis: JCV, HIV
- Panenzephalitis/myelitis: HSV-1, HSV-2, VZV, CMV, HIV, Masern, Arboviren
Histo: Initial polymorphonuklär, später mononukläres Infiltrat um die Blutgefäße, später parenchymale lymphozytäre und Makrophagen-Infiltrate. Neurone zeigen zytoplasmatische Einschlüsse, später Neurononophagie (Neuronenverlust mit residalen Mikrogliacluster). Bei Beteiligung der weissen Substanz ausgeprägte Astrogliose, Myelinverlust (PML), bei Panenzephalitiden ausgedehne hämorrhagische Nekrosen möglich.
Aseptische Meningitiden: kurzer benigner Verlauf mit lymphozytärer Pleozytose des Liquors, diskreten lymphozytären Infiltraten der Leptomingen sowie superfiziellen kortikalen Gefäßen. Erreger: Enteroviren, HSV-2 (rekurrierend: Mollaret-Meningitis), Mumps, HIV
Transverse Myelitis: horizontale Entzündung des Rückenmarkes weniger Segmente (auch bei MS oder Vaskulitiden möglich) Erreger: Enteroviren, Herpesviren, VZV, CMV, EBV
Fleckförmige Entzündungsherde in der grauen Substanz findet man z.B. bei:
- Tollwut - Ät.: Rabies-Virus. Infektion über Tierbiss. Mikro: Intrazytoplasmatische NEGRI-Einschlusskörperchen, perivaskuläre Entzündung. Klinik: Stadienhafter Verlauf: Prodromalstadium (Kopfschmerzen, Übelkeit, Reizbarkeit), Exzitationsstadium (Wesensänderung, Aggressivität, Übererregbarkeit, Speichelfluss und Schlundkrämpfe, Hydrophobie), paralytisches Stadium (Krämpfe, Lähmung, Tod). Prg.: Letalität fast 100 %.
- FSME (Frühsommer-Meningoenzephalitis) - Ät.: FSME-Virus. Überträger sind Zecken. Klinik: Biphasischer Verlauf: Erst Grippe-ähnliche Symptome, dann freies Intervall, dann evtl. Nackensteifigkeit, Lähmungen, Bewußtseinsstörungen.
 |
 |
Poliomyelitis/Polioenzephalitis
BearbeitenÄt.: Polio-Virus (Enteroviren) durch fäkal-orale Kontamination, dann hämatogene Ausbreitung Ep.: Seit Salk/Sabin-Impfstoffen selten, endemisch in Nordafrika, Indien, Pakistan, Afghanistan. Meist Kinder Klinik. Asymptomatisches Prodromalstadium, Muskelschwäche, Steifheit gefolgt von asymmetrischer Paralyse häufiger untere als obere Extremitäten, kraniale und bulbäre Symptome in 10-15% Nur ein kleiner Teil der Infizierten entwickelt das Krankheitsbild mit Lähmungen, Muskelatrophie und Post-Polio-Syndrom.
Makro: Diskoloration der betroffenen Regionen
Mikro: Verlust der α-Motoneurone in den Vorderhörnern des Rückenmarks, Pons, Olive. Ausgeprägte lymphozytäre Entzündung, initial auch neutrophile Granulozyten möglich. Mikrogliaknötchen. Neurogene Atrophie der Muskulatur.
 |
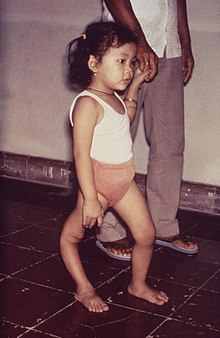 |
 |
Herpes-simplex-Enzephalitis
BearbeitenEp.: Nur 5-10 % der viralen ZNS-Infektionen, aber 90 % der Todesfälle. Häufigste Ursache akut nekrotisierender Enzephalitis (1/250.000)
Ät.: HSV 1 (selten HSV-2, vor allem bei neonataler Infektion)
Lok.: Hauptsächlich ist der Temporallappen betroffen (temperobasal über Bulbus olfactorius oder N. trigeminus).
Makro: Schwellung des Temporallappens.
Mikro: Hämorrhagisch-nekrotisierende Entzündung, perivaskulär gelegene Lymphozyteninfiltrate, Makrophagenansammlungen, Nachweis von COWDRY-bodies (intranukleäres homogenes eosinophiles Material, das Chromatin und der Nucleolus sind typischerweise an den Rand der Kernmembran gedrängt.) Bei ausgebrannten Enzephalitiden histologisch Kavitäten und Astrogliose. Bei Kindern chronische Verläufe mit granulomatösen Entzündungen und Verkalkungen möglich.
Klinik: Kopfschmerzen, Krampfanfälle, Meningismus, Fieber, psychiatrische Störungen, Vigilanzminderung.
Liquor: Virusnachweis mit DNA-PCR.
Prg.: Unbehandelt meist letal (wenn überlebt, dann mit schweren neuropsychiatrischen Schäden wie ungezügeltem Appetit, sexuelle Enthemmung, Aggressivität).
Varizella-Zoster-Enzephalitis
BearbeitenEp: ZNS-Beteiligung bei VZV-Infektion 1:1000 Fälle.
Ät: VZV v.a. Persistenz in autonomen Ganglien, Hirnnerven
Klinik: Cerebelläre Ataxie oder bei Infektion in utero: neonatale Embryopathien, Ganglionradikulitis mit Exanthem des betroffenen Dermatoms bei Gürtelrose
Histo: Im ZNS: hämorrhagische fibrinoide Nekrosen, Mononukläre Infiltrate, Mikrogliaknötchen, Makrophagen, Ependymale Einschlusskörperchen bei immungeschwächten Patienten
CMV Enzephalitis
BearbeitenEp: weltweit, vor allem bei Immunsupprimierten, über 80% der über 35-jährigen sind seropositiv.
Ät: CMV (Herpesviridae) durch engen Kontakt, Bluttransfusionen, Organtransplantationen oder neonatal über die Plazenta
Klinik: konnatal: Mikrozephalus, Retinitis, Schwerhörigkeit, Polimikrogyrie
Histo: Einzeln gelegene Zytomegaliezellen meist subependymal bei Ventrikulitis, Nekrosen, wenige Mikrogliaknötchen
 |
 |
 |
HIV-Enzephalitis
BearbeitenSyn.: HIV-Enzephalopathie
Ät.: HIV-1
Mikro: Diffuse Demyelinisierung des Marklagers in Groß- und Kleinhirn, reaktive Gliose, Mikrogliaknötchen, mehrkernige Riesenzellen.
Opportunistische Enzephalitiden
BearbeitenÄt.: Immunsupression, AIDS.
Erreger: Toxoplasma gondii, CMV, EBV, Cryptococcus spp., Aspergillus spp., HIV
Makro: Herdförmige Läsionen (Herdenzephalitis)
Mikro:
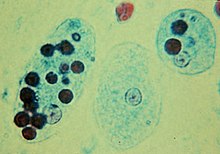
- Cryptococcus neoformans - Mikro: Typische runde Pilze mit Schleimkapsel.
- Aspergillus: Invasiv wachsende septierte Pilzhyphen mit spitzwinkliger (Y-förmiger) Verzweigung, Gefäß-affin. Gute Darstellung in der Grocott-Methenamin-Silber-Färbung.
- Toxoplasma gondii: Tachyzoiten/Bradyzoiten innerhalb Gewebezysten, Nachweis mit Toxoplasma-Antikörpern
Parasitäre Infektionen
Bearbeiten- Amöben (Entamoebica histolytica): Trophozoiten im Abszeßwall durch hämatogene Ausbreitung in das ZNS von der Leber aus möglich
- Malaria (meist Plasmodia falciparium): Schizonten können von den Erythrozyten in das ZNS gelangen, dort perivaskuläre Blutungen, kapilläre Nekrosen und Dürck'sche Granulome verursachen
- Toxoplasmose (meist Toxoplasmodia gondii): Tachzyoiten (ovale 2-8µm) oder Zysten mit Bradyzoiten inmitten eines mononuklären Infiltrates, Intimaproliferate, fibrinoide Nekrosen. Immunhistochemischer Nachweis möglich.
- Trypanosomiasis (T. rhodiense, gambiense, cruzii): meist meningeales, seltener auch parenchymales Infiltrat aus glasigen Plasmazellen mit reaktiver Astrogliose
- Zysterzikose (Taenia solium): Der zu den Cestoden zählende Bandwurm ist der häufigste ZNS-Parasit. Das ZNS zeigt erst nach Absterben des Parasitens eine granulomatöse inflammatorische Reaktion mit Eosinophilie, mehrkernigen Riesenzellen. Der Parasit ist an seinem Scolex gut identifizierbar.
- Echninokokkose (E. granulosus, multolocularis): nur 1% der Befälle ist auch das ZNS mit hyatiden Zysten betroffen
- Schistosomiasis (meist S. japonicum): Granulome in Knötchen aufgebaut, aufgrund der retrograden Ausbreitung über den venösen Fluss meist in der Dura mater.
Pilzinfektionen (Mykosen)
BearbeitenDie Inzidenz von Pilzinfektionen ist zunehmend (Organtransplantationen, Neoplasien, HIV). Klinisch können sie als diffuse Enzephalitis, Meningitis, fokale Myzetome der Meningen, Granulome und Abzesse imponieren.
Die häufigsten Mykosen mit ZNS-Beteiligung sind:
- Cryptococcus neoformans (am häufigsten)
- Aspergillus spp.
- Candida spp.
- Blastomyzeten
- Coccoides immitis
- Histoplasma capsulatum
- Zygomyzeten
 |
 |
 |
Zerebrale Aspergillose
BearbeitenEp: 10-20% der Patienten mit pulmonaler Aspergillose entwickeln ZNS-Aspergillose.
Ät: Aspergillus fumigatus (am häufigsten), flavus, terreus, niger, meist nach Organtransplantation, bei HIV eher selten.
Klinik: meist multiple Abzesse, ausgedehntes Ödem.
Makro: Nekrotisch, hämorrhagisch.
Histo: Septierte spitzwinklig verzweigte Hyphen.
SF: Anfärbbar mittels PAS (rot) oder GMS (schwarz).
Prg: Extrem hohe Mortalität (90%) bei ZNS-Aspergillose, Subarachnoidalblutungen durch mykotische Aneurysmen möglich.
Siehe auch: Abschnitt Aspergillus in Lehrbuch Mikrobiologie.
 |
 |
Candidasis
BearbeitenEp.: 9 humanpathogene Spezies (von 150), ZNS-Infektion selten.
Histo: Nekrosen, Inflammatorische Zellen, Vaskulitis, 2-3µm große gekapselte Hefen, an Pseudohyphen aneinandergereiht (PAS oder Silberfärbungen optimal).
Siehe auch: Abschnitt Candida in Lehrbuch Mikrobiologie.
Blastomykose
BearbeitenEp: ZNS-Beteiligung in weniger als 5% der Infektionsfälle, davon 40% HIV-assoziert.
Histo: Granulomatöse Reaktion, 8-15µm große Hefen in Makrophagen sichtbar.
Immune reconstitution inflammatory syndrome (IRIS)
BearbeitenÄt: Entzündliche Exazerbation durch Rückkehr der Immunkompentenz bei zuvor bestehender Immundefizienz. Auftreten insbesondere unter HAART-Therapie bei HIV oder Absetzen einer anti-alpha4-Integrin Antikörpern (Natalilzumab) bei Multiple Sklerose.
Bildegbung: Kontrastmittel-aufnehmende, progrediente Läsion
Histo: Extensives CD8-dominiertes T-Zell Infiltrat sowohl in demyeliniserten als auch normal myelinisierten ZNS-Arealen. Darunter ca. 30% Plasmazellen, einzelne B-Zellen
DD: Progressive multifokale Leukoenzephalopathie (wenige Plasmazellen, keine B-Zell Infiltrate)
Diffuse perivenöse Herdenzephalitis
Bearbeiten- Postinfektiös/postvaccinal (am peripheren Nervensystem : GUILLAIN-BARRÉ-Syndrom)
- Paraneoplastisch
Rasmussen-Enzephalitis
BearbeitenEP: seltene chronische inflammatorische Störung unbekannter Ätiologie mit meist einseitiger Beteiligung des Gehirns, welches eine unilaterale Atrophie einer Hemisphäre aufweist.
Histo: Chronische Inflammation (T-Lymphozyten, Mikroglia, Makrophagen perivaskulär), Astrogliose, Neuronenverlust. Einschlusskörperchen viraler Enzephaliden sind nicht vorhanden.
Ko: Therapierefrektäre epileptische Anfälle, bei Kindern kognitive Einbußen
 |
Andere
Bearbeiten- Limbische Enzephalitis - Ät.: Paraneoplastisch.
Demyelinisierende Erkrankungen
BearbeitenZu den demyelinisierenden Erkrankungen zählen:
- Mutiple Sklerose (MS)
- Progressive multifokale Leukoenzephalopathie
- Zentrale pontine Myelinolyse
Die häufigste demyelininisierende Erkrankung ist die MS. Ihr entspricht im peripheren Nervensystem die Inflammatorische Demyelinisierende Polyradikuloneuropathie (Guillain-Barré Syndrom-GBS). Beide werden zu den autoimmunbedingten entzündlichen Erkrankungen gezählt.
Hiervon abzugrenzen sind Erkrankungen bei denen die Myelinisierung bereits von Beginn an fehlt, hier handelt es sich um eine kongenitale Leukodystrophie.
Encephalomyelitis disseminata (ED)
BearbeitenSyn.: Multiple Sklerose
Ep.: Prävalenz: 120.000 in Dtl. Frauen häufiger als Männer, Erkrankungsbeginn um das 30. Lj. Die Lebenserwartung ist gegenüber der Normalbevölkerung um 5-10 Jahre reduziert.
Ät.: Autoimmunologische Reaktion gegen Markscheiden, evtl. viral getriggert bei genetischer Prädisposition (Konkordanzen bei Zwillingen). Umwelteinflüsse scheinen ebenfalls eine Rolle zu spielen, da die Prävalenz von Nord nach Süd abnimmt.
Pg.: Autoaggressive Entmarkung mit partieller Remyelinisierung (-> teilw. vorübergehende Funktionsstörungen) -> Gliose (Vernarbung) -> Sklerose.
Klinik: Optikusneuritis (typische Erstmanifestation mit akutem einseitigen Visusverlust bei unauffälligem ophthalmoskopischem Befund), Kleinhirnsymptome, Trigeminusneuralgie, spastische Paraparese, Sensibilitätsstörungen, UTHOFF-Phänomen (Symptomsteigerung bei Temperaturerhöhung), LHERMITTE-Phänomen (elektrisches Gefühl an Armen und Rücken bei Kopfbeugung), internukleäre Opthalmoplegie (Doppelbilder und dissoziierter Nystagmus bei funktionierender Konvergenz durch Schädigung des medialen Längsbündels, das den Nc. n. VI mit dem kontralateralen Nc. III verbindet), Dranginkontinenz/Detrusor-Sphinkter-Dyssynergie.
Lok.: Überwiegend weiße Substanz, bevorzugt periaquaeduktal, im Corpus callosum, periventrikulär und im zervikalen Myelon (transverse Myelitis). Neuritis nervi optici (Retrobulbärneuritis). Kortikale Plaques liegen oft am Übergang zur weissen Substanz.
Befallsmuster:

- Marburg: fulminanter Verlauf, Tod innerhalb weniger Jahre
- Schilder: akut progredient, konfluent demyelinisierend
- Balo: konzentrische Ringe mit partieller Beibehaltung des Myelins
Verlauf: Variabel. Schubweise, primär oder sekundär chronisch progredient.

Makro: Multiple (manchmal nur einzelne) scharf demarkierte graue unregelmäßig konturierte Herde in der weißen Substanz.
Ablauf: In der Akutphase werden die Myelinscheiden durch Mononukäre Zellen (Oligodendroglia, Lymphozyten, Mikroglia und Makrophagen) zerstört. Daher enthalten im Anfangsstadium die Makrohagen phagozytierte Myelinfragmente und Proteinbestandteile und später Lipide aus der Degradation des Myelins. Mit der Zeit kommt es zu einer reaktiven Astrogliose und ausgebrannte Plaques mit reduziertem Axonbesatz inmitten des gliotischen Gewebes entstehen. Kommt die Entzündung frühzeitig zum Stillstand, erfolgt eine partielle Remyelinisierung der erhaltenen Axone. Im fortgeschrittenen Stadium ist die Gliose so ausgeprägt, daß die Axone nicht mehr remyelinisiert werden können.
Mikro: Plaques imponieren nur als Abblassung in der HE, Fehlende Myelinscheiden in der LFB-Färbung. Perivaskuläres Infiltrat (kleine postkapilläre Venolen), Lymphozyten, Makrophagen, aktivierte Mikroglia, perivaskuläres Ödem.
Einteilungsmuster der aktiven Läsionen (Luchinetti et al.):
- Type I: Immunglobulinablagerungen
- Type II: Immunglobulin- und Komplementkomplex-Ablagerungen, Ansprechen auf Plasmapharese
- Type III: Oligodendrozyten-Apoptose, Läsion diffuser als bei I+II.
- Type IV: untergehende Oligodendrozyten in der angrenzenden weissen Substanz
Immuno: CD8+ Lymphozyten perivaskulär, weniger CD20-positive B-Zellen und Plasmazellen, Nachweis Mikroglia und Makrophagen mit CD68
Liquor: Reife Plasmazellen. Reiber-Schema: Intrathekale Ig-Synthese. IEF: Oligoklonale Ig-Banden in > 90 %.
DD.: Querschnittsmyelitis, Neuromyelitis optica, Akute demyelinisierende Enzephalomyelitis, Zerebrale Vaskulitis, Morbus Alexander
Siehe auch: Hauptartikel der Wikipedia.
 |
 |
Neuromyelitis optica (NMO)
Bearbeiten(DEVIC-Syndrom)
Ät: Aquaporin 4 Autoantikörper gegen Astrozyten der Blut-Hirn-Schranke
Klin: Optikusneuritis (bilateral) und Myelitis > 3 Segmente.
Liquor: Pleozytose, Eiweiß erhöht, keine oligoklonalen Banden.
Akute demyelinisierende Enzephalomyelitis (ADEM)
Bearbeiten
postinfektiöse Enzephalomyelitis
Ät.: Immunoallergisch T-Zell vermittelte Reaktion, para/postinfektiös bei EBV, CMV, Mykoplasmen
Ep: meist Kinder mit akut einsetzender Hemiplegie
Makro: Große monophasische Herde, bilaterale Opticusneuritis
Histo: perivenöse Entzündung und Entmarkungsherde bei erhaltenen Axonen
Liquor: Leichte lymphozytäre Pleozytose, Eiweiß normal oder gering erhöht, intrathekale IgG-Synthese (parallel IgM- und IgA-Synthese), keine oligoklonalen Banden.
Klinik: Kopfschmerzen, Fieber, Vigilanzstörungen, fokale Ausfälle.
Akute hämorrhagigsche Leukoenzephalopathie (Weston-Hurst-Syndrom)
Bearbeiten
Ät: möglicherweise hyperakute Form der ADEM
Klinik: In 50% fiebriges Prodromalstadium (1-15 Tagen), meist fataler Verlauf (Tod zwischen 1-5 Tagen)
Liquor: normal bis Pleozytose (Neutrophilie)
Histo: Nekrotisierende Herde mit Demyelinisierung
Progressive multifokale Leukenzephalopathie (PML)
BearbeitenÄt.: Reaktivierung des JC-Virus in lytischen Oligodendrozyten bei Immundefizienz (AIDS, MS-Immuntherapie, Organtransplantationen)
Klinik: Visuelle Ausfälle, Demenzen, Paralysen
Histo: bizarre, vergrößerte Astrozyten, Mikroglia- und Makrophagenaktivierung, Viruspartikel in Oligodendroglia (immunhistochemischer JC-Virus-Nachweis), Inflammation ist normalerweise gering.
 |
 |
Entzündliche Gefäßveränderungen
BearbeitenFür systemische Vaskulitiden mit cerebraler Beteiligung siehe Abschnitt Primäre Vaskulitiden im Kapitel Gefäße.
Arteriitis temporalis
BearbeitenRiesenzellarteriitis, Morbus Horton
Ep: selten vor dem 70. Lj. Frauen häufiger als Männer betroffen
Lok: meist temporale, posteriore ciliäre und opthalmische Arterien
Makro: verdickte noduläres Gefäße
Histo: segmental vorkommende Entzündungszellen vorwiegend in der Media bestehend aus Lymphozytenund Plasmazellen. Eosiniophile und neutrophile Granulozyten können vorkommen. Die Intima ist fibrotisch verdickt. Multinukläre Riesenzellen zwischen Intima und Media sind diagnostisch, kommen jedoch nicht in allen Fällen vor. In Fällen nach abgelaufener Entzündung bleibt eine Fibrose und Fragmentierung der elastica interna zurück. Transmurale Nekrosen wie bei der Polyarthritis fehlen.
Ko: Visusverlust
Granulomatöse Angiitis
BearbeitenEp: Erwachsene, Männer häufiger als Frauen betroffen
Histo: Epitheloide Histiozyten. Lymphozyten und Riesenzellen in der Wand arterieller und venöser Gefäße des Hirnparenchyms oder Leptomeningen
Beta-Amyloid-assoziierte Angiitis
Bearbeitenamyloid-beta related angiitis, ABRA
Ep: selten, meist im höheren Lebensalter (60-70 Lj.) vorkommend
Histo: granulomatöse Veränderungen der Gefäße, Nachweis von Amyloid in den Gefäßwänden, Astrogliose des angrenzenden ZNS.
DD: Kongophile Angiopathie
Buch-Navigation