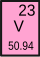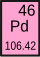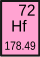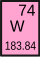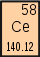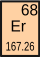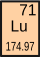Wikijunior Die Elemente/ Druckversion
Mit diesem Buch lernst du die Welt der Chemie kennen. Du wirst erfahren, wie Materie aufgebaut ist, was sie zusammenhält und wie sie miteinander reagiert – und du wirst ein paar sehr interessante Elemente kennen lernen. Ein Element ist die reinste Form, aus der ein Ding bestehen kann – und du wirst sehen, wie man verschiedene Elemente verbinden kann.
Dieser Text ist sowohl unter der „Creative Commons Attribution/Share-Alike“-Lizenz 3.0 als auch GFDL lizenziert.
Eine deutschsprachige Beschreibung für Autoren und Weiternutzer findet man in den Nutzungsbedingungen der Wikimedia Foundation.
Die Elemente

Übersetzt und erweitert von freiwilligen Helfern bei
de.wikibooks.org
einem Wikimedia Foundation Projekt
Periodensystem
Bearbeiten
 |
| ||||||||||||||||||||||||||
Über das Buch
BearbeitenDieses Buch wird vielleicht dein erstes richtiges Chemiebuch sein. Wenn du in der dritten oder vierten Klasse bist, ist das Buch genau richtig, um die Welt der Chemie kennen zu lernen. Wenn in der fünften Klasse der Chemieunterricht beginnt, hast du schon einen kleinen Vorsprung – und auch in der sechsten Klasse wird dir das Buch vielleicht noch beim Lernen helfen.
Was ist eine Materie?
Bearbeiten
Graphit besteht hauptsächlich aus dem Element Kohlenstoff.
Du möchtest etwas über die „Elemente“ erfahren? – Dann werde ich dir etwas über Chemie erzählen ...
Chemie ist die Wissenschaft, die sich damit beschäftigt, woraus die Dinge gemacht sind, wie man sie verändern kann und wie sie mit anderen Dingen reagieren. Nun ja, das sagt dir vielleicht noch nicht viel – aber es ist auch ein langer Weg, alles über die Chemie zu lernen.
Alles auf der Erde, alles im Sonnensystem und in der Milchstraße, wirklich alles im ganzen Universum besteht aus Materie. Na ja, das Licht, mit dem dein Bildschirm gerade leuchtet, und der Strom, den dein Computer gerade verbraucht, ist keine Materie, sondern Energie. Aber alles, was du anfassen kannst, was du sehen, fühlen, riechen oder schmecken kannst – das alles ist „Materie“ – das ist der Name, den die Wissenschaft den Dingen um uns herum gegeben hat. Materie nimmt einen Platz ein und sie hat ein Gewicht – die Wissenschaft sagt, Materie hat Volumen und Masse. Man kann auch sagen, Materie hat Substanz. Deshalb nennt man auch viele Dinge in der Chemie Substanzen. Ein anderer Begriff dafür ist Stoff.
Erscheinungsformen der Materie
BearbeitenEin Stoff, den du gut kennst, ist Wasser. Hagel, Schnee, Regen, Wolken, Flüsse, Eisberge usw. bestehen aus Wasser. Jeder Stoff kann in mehreren Formen auftreten, die sehr unterschiedliche Eigenschaften besitzen. Eine Aufgabe von Chemikern ist es, die Eigenschaften von Stoffen zu untersuchen, eine andere, Stoffe umzuwandeln.
Experiment:
Führe mit Erlaubnis deiner Eltern folgendes Experiment durch:
Stelle eine Schale mit Wasser in das Tiefkühlfach. Betrachte alle 30 Minuten das Ergebnis und teste mit dem Finger die Temperatur. (Hinweis: Wissenschaftler notieren ihre Beobachtungen.)
Nimm die Schale aus dem Tiefkühlfach, wenn das Wasser vollständig gefroren ist. Gebe das Eis in einen Topf und erhitze es auf dem Herd. Solange Eis im Topf ist, kannst du im Abstand von einer Minute mit dem Finger in das Wasser fassen und eine interessante Beobachtung machen. (Achtung: Wenn Blasen aufsteigen, verbrüht man sich an dem Wasser!)
Am besten, du machst es gemeinsam mit deinen Eltern.
Wie du siehst, weißt du bereits aus dem Alltag eine Menge über Chemie. Die folgenden Seiten sollen dir helfen, dein Wissen zu erweitern.
Eine Sammlung anlegen
BearbeitenEine Möglichkeit sich Dinge im Wortsinn begreifbar zu machen sind Sammlungen.
- Es gibt verschiedene Möglichkeiten:
- Eine Mineraliensammlung (vielfältige Verbindungen von unterschiedlichen Elementen)
- Eine Sammlung von besonders schönen Gesteinen (Kristalle, Versteinerungen)
- Eine Sammlung der Elemente (sehr schwierig, so etwas wird Dir im Chemieunterricht später begegnen. Elemente wie Eisen und Aluminium sind noch vergleichsweise einfach, aber viele Elemente sind gar nicht „rein“ und/oder „fest“ zu bekommen.)
Du kannst im Laufe der Zeit den Schwerpunkt deiner Sammlung noch verändern. Du wirst dabei eine Menge über Chemie lernen. Viele Wissenschaftler haben mit einer Sammlung angefangen und sich im Laufe der Zeit zu Experten entwickelt.
Besonders viel Freude an deiner Sammlung wirst du haben, wenn auch deine Freunde mit dem Sammeln beginnen. Ihr könnt euch gegenseitig eure Objekte zeigen und untereinander tauschen.
Woher bekomme ich meine Sammlungsstücke?
BearbeitenGesteine findet man in der Umgebung, bei Ausflügen im Urlaub usw. Nicht alle Grundstücke dürfen betreten werden, und an einigen Orten ist es verboten, Steine zu sammeln.
Viele Elemente findet man im Alltag. Bei den Metallen ist es teilweise schwer, sie voneinander zu unterscheiden. Wenn du schöne Objekte bekommst, kannst du sie sicher später noch bestimmen.
Am besten, du sammelst auf gemeinsamen Ausflügen mit deinen Eltern.
Worauf muss ich achten?
BearbeitenSammlungen können sehr schnell wachsen. Kleine Objekte kann man besser lagern als große. Beschränke dich auf schöne Sammlerstücke!
Die Sammlerstücke sollten beschriftet werden. (Bei Gesteinen ist der Fundort wichtig.) Wenn du sie nummerierst, kannst du am Computer eine Liste mit allen dir bekannten Informationen erstellen.
Im Internet findest du interessante Seiten, wenn du den Begriff „Gesteinssammlung“ oder „Elementsammlung“ in eine Suchmaschine eingibst. Hier bekommst du auch Anregungen für die Lagerung. Zu Beginn reicht eine Pappkiste.
Materie
BearbeitenEin Stoff kann so unterschiedliche Zustände einnehmen, dass man kaum noch erkennt, dass es sich um den gleichen Stoff handelt. Diese Zustände der Materie nennen wir Aggregatzustände:
|
Diese Körper behalten ihre Form. Du brauchst Kraft, um sie zu verbiegen oder zu zerbrechen. |
Flüssigkeiten nehmen jede Form eines Behälters an und können auf anderen Dingen fließen. Sie haben aber noch so viel Zusammenhalt, dass zum Beispiel eine Wasseroberfläche entsteht. Flüssigkeiten lassen sich leicht teilen. |
Auch Gase nehmen die Form ihres Behälters an, und sie füllen ihn vollständig aus. Man kann jedoch keine Oberfläche sehen (Wolken sind – streng genommen – keine Gase, mehr dazu unten im Abschnitt Gase). |
Tauen/Verflüssigen/Schmelzen ↔ Gefrieren/Erstarren
Verdampfen ↔ Kondensieren
Sublimieren ↔ Resublimieren (Achte bei Schnee in der Sonne mal auf „dampfenden Schnee“)

Stoffe können den Aggregatzustand wechseln, wenn sich die physikalischen Größen ändern. Die Betonung liegt auf physikalisch, denn egal ob er fest, flüssig oder gasförmig ist, es bleibt chemisch immer noch derselbe Stoff. Ob Eis, Wasser oder Wasserdampf, es ist immer noch Wasser. Der Aggregatzustand hängt von den beiden physikalischen Größen Temperatur und Druck ab.
Wenn du etwas erhitzt, speicherst du Wärme im Stoff. Je mehr Wärme ein Körper enthält, um so heißer ist er. Aber am Schmelzpunkt und am Siedepunkt passiert etwas Interessantes mit der Temperatur. Wenn Eis schmilzt, bleibt die Temperatur bei 0 °C „stehen“, bis das ganze Eis geschmolzen ist, obwohl immer mehr Wärme dazu kommt. Wo bleibt diese Wärme, die Energie? – Sie ist nötig, um die starken Bindungen aufzubrechen, die das Eis als Feststoff so fest machen. Den gleichen Effekt kannst du beobachten, wenn Wasser kocht: Die Temperatur wird bei 100 °C stehenbleiben, bis der letzte Tropfen verdampft ist. Die Wärme wird erstmal gebraucht, um das Wasser zu Dampf zu machen.
Umgekehrt entzieht man dem Stoff Energie, wenn er abkühlt. Wenn Wasser zu Eis gefriert, wird die Temperatur wieder bei 0 °C stehenbleiben, bis das ganze Wasser „fest“ (also Eis) geworden ist. Solange kommt die Energie „aus dem Wasser wieder raus“.
Dass der Aggregatzustand von der Temperatur abhängt, können wir jeden Tag sehen, wenn Wasser in einem Topf kocht oder wenn es im Gefrierschrank zu Eis wird (warum der Kühlschrank Energie braucht, statt sie zu liefern, können wir an dieser Stelle leider nicht erklären). Aber auch der Luftdruck hat einen wichtigen Einfluss auf den Aggregatzustand. Im Gebirge, in mehreren Tausend Metern Höhe, wo ein sehr geringer Luftdruck herrscht, kocht Wasser schon bei 70 °C und noch weniger.
Manche festen Stoffe werden beim Erhitzen gar nicht erst flüssig, sondern gleich gasförmig. Sie überspringen die flüssige Phase einfach. Das nennt man dann sublimieren. Die Elemente Kohlenstoff und Jod sind Stoffe, die sublimieren. Auch Trockeneis – das ist Kohlendioxid, das etwa bei unglaublichen - 80°C fest wird – wird wieder zu Gas, ohne zu schmelzen. Daher kommt der Name „Trockeneis“. Der Grund ist der Druck. Im vorhergehenden Absatz hast du gelesen, dass niedriger Druck die Siedetemperatur verringert.
Festkörper
BearbeitenWas macht sie so fest?
Bearbeiten
Feste Körper sind meistens sehr hart. Es ist sehr schwer, sie zu zerbrechen oder zu verbiegen. Der Grund ist, dass zwischen den Molekülen und Atomen sehr starke Bindungskräfte herrschen. In Festkörpern hat jedes Atom einen festen Platz, an dem es durch die Bindungskräfte festgehalten wird. Es ist schon viel Kraft nötig, um diese Bindungskräfte aufzubrechen. Im Gegensatz dazu können sich die Atome in Gasen und Flüssigkeiten ziemlich frei bewegen.
Kristalle
BearbeitenEine besondere Form von Festkörpern sind Kristalle. Alle Metalle, viele Salze und manch kompliziertere Stoffe – wie Zucker – sind wie ein Kristall aufgebaut. Wir sagen auch, sie haben einen „kristallinen Aufbau“. Das bedeutet, dass die Atome in einer ganz bestimmten Art und Weise, einer Art Muster, angeordnet sind. Dieses Muster wiederholt sich immer wieder und wenn ein Kristall in Ruhe wachsen kann, kann man dieses Muster sogar mit bloßem Auge erkennen.
Die Kristalle von Kochsalz sind zum Beispiel würfelförmig. Hübsch sind auch Zuckerkristalle, die man in groß sogar als „Kandis-Zucker“ kaufen kann. Im Kapitel über Lösungen und Salze kannst du noch mehr erfahren. Dort zeigt dir ein Experiment, wie du Kristalle aus Salz züchten kannst. Das Kapitel Wir züchten Kristalle zeigt dir das gleiche mit Zucker.

Ein und derselbe Stoff kann je nach Temperatur und Druck sogar verschiedene Kristallformen annehmen. Kohlenstoff ist dafür ein gutes Beispiel:
Der Diamant besteht aus Kohlenstoff-Atomen, die in einer komplizierten Form angeordnet sind. Diese Form kann nur bei sehr hohen Temperaturen und bei großem Druck entstehen. Diamanten entstehen im Inneren der Erde, viele Kilometer unter der Oberfläche. Beim Ausbruch eines Vulkans werden sie schnell abgekühlt und in ihrer Form „eingefroren“. Ein Diamant ist durchsichtig und der härteste Stoff, den wir kennen.
Als Graphit hat Kohlenstoff eine schwarze Farbe und ist lange nicht so hart wie der Diamant. Das Atomgitter sieht aus wie sechseckige Platten, die in Schichten übereinander liegen. Die Mine eines Bleistifts besteht aus Graphit, genauso wie Kohle. Auch der Ruß einer Kerze ist Graphit.
Flüssigkeiten
Bearbeiten
Als nächstes reden wir über Flüssigkeiten. Wasser ist das beste Beispiel für eine Flüssigkeit. Es kann fließen und es nimmt die Form jedes Behälters an, in den du es gießt. Die Moleküle halten lange nicht so fest zusammen wie bei Feststoffen. Sie können an jeden beliebigen Platz „schwimmen“. Sie versuchen aber, einen bestimmten Abstand zueinander zu halten. Deshalb verbinden sich kleine Wassertropfen zu größeren Pfützen.
Die Bindungskräfte sorgen auch dafür, dass Flüssigkeiten nicht zusammen gedrückt werden können.
Experiment: Kauf in der Apotheke eine kleine Spritze (du kannst sie nach dem Experiment zum Spielen in der Wanne oder draußen benutzen), sie kostet nur wenige Cent. Zieh sie einfach mit Luft auf und halte mit dem Daumen die Öffnung zu. Du wirst sie jetzt trotz verschlossener Öffnung ein bisschen zusammendrücken können. Nun zieh sie mit Wasser auf: Jetzt kannst du sie sicher nicht mehr zusammendrücken, wenn Du die Öffnung zu hälst (du kannst aber prima die Blumen aus einiger Entfernung gießen, wenn Du den Daumen weg nimmst! Mach das besser nur draußen ![]() ).
).
Besondere Flüssigkeiten
BearbeitenUnterkühlte Flüssigkeiten sind zwar fest, konnten aber beim Erstarren keine Kristalle bilden. Das geschmolzene Material ist sehr, sehr schnell abgekühlt worden, so hatten die Kristalle hatten keine Zeit zu wachsen. Man kann auch sagen, dass die Struktur der Atome in der Flüssigkeit „eingefroren“ wurde.
Manchmal sind es ein paar „Zutaten“ in der Schmelze (so nennt man die Flüssigkeit, die entsteht, wenn etwas „geschmolzen“ wird), die auf chemische Art verhindern, dass sich Kristalle bilden. Diese Möglichkeit benutzt man, um Glas herzustellen. Das Glas behält dabei sogar einige Eigenschaften der Flüssigkeit.
Manchmal können sich gemischte Flüssigkeiten sogar verhalten wie Feststoffe: Mischt man Stärke mit Wasser im richtigen Verhältnis, so kann man auf die Oberfläche drauf hauen und kommt nicht hinein. Wenn man aber den Finger langsam „rein bohrt“ ist es kein Problem. Mehr zu Mischungen erfährst du im entsprechenden Kapitel Mischungen.
Gase
Bearbeiten
Unsere Erde ist von einer Hülle umgeben, die Atmosphäre heißt. Sie besteht aus Luft – und Luft ist ein Gas-Gemisch. Sie enthält vor allem Stickstoff (ungefähr 8 von 10 Luft-Teilen) und Sauerstoff (etwa 2 von 10 Luft-Teilen). Außerdem sind kleine Anteile von Kohlendioxid (das Gas was wir ausatmen) und sogenannten Edelgasen enthalten. Ohne Sauerstoff könnten alle Tiere und auch wir Menschen nicht leben. Ohne Kohlendioxid könnten Pflanzen nicht leben. In den Kapiteln Argon oder Helium erfährst du etwas über diese zwei Edelgase. Es gibt noch mehr.
Die meisten Gase sind eigentlich unsichtbar. Rauch, Nebel oder Wolken kannst du sehen, weil winzig kleine feste oder flüssige Stoffteilchen in der Luft umherfliegen.
Gase können die Form jedes Behälters annehmen, und sie füllen ihn vollständig aus. Gase können komprimiert werden. Das heißt, eine Gasmenge kann mit Kraft zu einem kleineren Volumen zusammengepresst werden (so wie im Experiment oben).
Die Bindung zwischen den Gasmolekülen ist fast ganz verschwunden. Die Moleküle „versuchen“ noch alle denselben Abstand zu halten, aber sie können völlig frei umherfliegen.
Plasma
Bearbeiten
Wenn man Gase sehr stark erhitzt, fangen sie an sichtbar zu leuchten. Diesen Zustand nennt man Plasma. Plasma findest Du bei der Kerzenflamme, auf der Sonne und auch Blitze sind Plasma.
Die Aggregatzustände fest, flüssig und gasförmig sind sich ähnlich darin, dass die einzelnen Teilchen, aus denen die Stoffe bestehen, sich verschieden schnell bewegen und unterschiedlich stark zusammenhängen. So ist beispielsweise Blei bei Zimmertemperatur fest, schmilzt bei 327 °C und wird bei mehr als 1744 °C gasförmig. Je heißer die Substanz ist, desto schneller bewegen sich die Teilchen.
Bei sehr hohen Temperaturen sind sie so schnell, dass Plasma entstehen kann. Die einzelnen Moleküle und Atome, aus denen die Materie besteht, verändern sich durch viele Zusammenstöße. Sie zerbrechen und/oder laden sich elektrisch auf. Geladene Teilchen nennt man Ionen. Durch dieses Zerbrechen und Aufladen entsteht das Leuchten.
Aggregatzustand und Energie
Bearbeiten
Wenn man Eis in einem Topf über einem Feuer erwärmt, kann man beobachten wie das Eis langsam schmilzt. Obwohl die heißen Flammen unter dem Feuer lodern, bleibt die Temperatur gleich: Ein ins Schmelzwasser gestelltes Thermometer zeigt ständig 0 °C an. Erst wenn alles Eis geschmolzen ist, steigt die Temperatur weiter an. Die Energie des Feuers wurde benötigt, um die aneinanderklebenden Wasserteilchen voneinander zu lösen. Diese Energie ist nicht verloren und steckt nun im Wasser.
Obstbauern nutzen diese Energie, um ihre Obstbäume bei einem Frosteinbruch zu schützen. Also, wenn es nochmal so richtig kalt wird, obwohl die Bäume bereits Knospen haben. Die Bauern besprengen die Bäume mit Wasser. Das Wasser gibt beim einfrieren die gespeicherte Energie als Wärme wieder ab und „heizt“ damit die Bäume. Die Knospen sind zwar von einer dicken Eisschicht bedeckt, aber die Temperatur sinkt nicht unter 0 °C, weil ja das Wasser gefrieren muss. Das vertragen die Bäume.
Was sind Elemente?
BearbeitenDas Universum ist aus Materie aufgebaut. Jetzt, in diesem Moment bist du davon umgeben. Die Luft die du atmest, die Gerüche die du wahrnimmst - alles, was du sehen kannst ist Materie. Materie ist alles, was einen Raum einnimmt und Gewicht hat. Die Wissenschaftler sagen, Materie hat Volumen und Masse.
Schon seit langem haben Menschen darüber nachgedacht, ob die Materie aus wenigen Grundbauteilen zusammengesetzt ist. (Etwa so, wie ein Kasten mit Bauklötzen, aus dem man sehr viele verschiedene Dinge bauen kann.) Im Altertum haben die Gelehrten geglaubt, Erde, Wasser, Luft und Feuer seien die "Vier Elemente", also die Grundstoffe, aus denen alle anderen Stoffe bestehen. Diese Vorstellung war falsch. Heute wissen wir, es handelt sich dabei um die Aggregatzustände fest ("Erde"), flüssig ("Wasser"), gasförmig ("Luft") und Plasma ("Feuer"). Aggregatzustände beruhen darauf, dass die einzelnen Bauteile verschieden stark aneinander kleben. Es sind somit keine Bauteile.
Die Gelehrten des Altertums hatten aber mit ihrer Idee, dass unsere Materie aus Grundstoffen aufgebaut ist, recht. Es gibt in der Chemie etwa hundert verschiedene Grundstoffe, die wir Elemente nennen: Eisen, Gold, Silber, Schwefel, Phosphor usw. Diese Elemente können unterschiedliche Aggregatzustände einnehmen.
Die Bauteile, aus denen die Elemente bestehen nennt man Atome. Oder anders herum betrachtet: Etwas das nur aus einer Art von Atomen besteht nennen wir Element.
Heute können wir uns Atome ansehen, indem wir ein Gerät benutzen, das „Elektronen-Mikroskop“ heißt. Damit kann man Dinge sehen, die sogar noch Millionen mal kleiner sind als das, was uns normale Mikroskope zeigen.

Die Welt der Elemente
BearbeitenDie meisten Dinge um uns herum bestehen aus mehr als einem Element, aber manche Dinge bestehen auch nur aus einem einzigen. Stell dir mal einen Diamanten vor: er besteht aus einem Element, das wir Kohlenstoff nennen - und nun denk mal an die Mine deines Bleistifts: Sie ist übrigens nicht aus Blei! - Sie ist, genauso wie der Diamant, aus Kohlenstoff. Das Element hat nur eine andere Struktur: man nennt es Graphit. Die Eigenschaften der Dinge hängen nicht nur davon ab, aus welchen Elementen sie bestehen, sondern auch davon, in welcher Form die Atome angeordnet sind. Kohlenstoff kann also als Diamant klar wie Glas sein – oder tiefschwarz als Graphit.
Hier ein paar Beispiele für Dinge, die aus einem Element sind:
- Eine Getränkedose aus Aluminium.
- Wertvoller Schmuck aus Gold oder Silber.
- Das Gas Helium in einem Ballon, der nach oben fliegt, wenn du ihn loslässt.
Um ehrlich zu sein: Sehr oft gibt es Verunreinigungen durch andere Elemente. Diese Beispiele sind darum eigentlich keine reinen Elemente. Und gerade Metalle werden oft mit anderen Metallen gemischt, um ihre Eigenschaften zu verbessern. Wäre der „eiserne Gartenzaun“ wirklich aus Eisen, könntest du ihn verbiegen. Tatsächlich ist er aus Stahl. Stahl besteht aus dem Element Eisen, dem andere Elemente wie Kohlenstoff oder Mangan zugefügt wurden.
Nur wenige Elemente kommen in der Natur als reine Elemente vor. Gold und Schwefel kann man in reiner Form finden – oder Kohlenstoff als Diamant. Aber die meisten Elemente findet man nur in Verbindung mit anderen Elementen. Ein Beispiel:
H2O. Das bedeutet, dass ein Wasser-Molekül aus zwei Atomen Wasserstoff (H) und einem Atom Sauerstoff (O) besteht. |
Als Moleküle werden Gruppen von Atomen bezeichnet, die durch chemische Bindung zusammen gehalten werden. Es gibt Moleküle, die aus verschiedenen Atomen, also verschiedenen Elementen aufgebaut sind, wie die des Wassers. Andere Moleküle bestehen aus mehreren gleichen Atomen. So treten Atome des Sauerstoffs (O) in der Luft fast immer zu zweien gepaart auf. Gruppieren sie sich dagegen zu dritt, entsteht das giftige Ozon. Dies ist ein weiteres Beispiel, dass ein und das selbe Element verschiedene Eigenschaften haben kann.
Die Menschen des Altertums wussten schon, wie man Elemente trennt – z. B. wie man das Eisen aus dem Eisenoxid in Erzen herausholt. Sie erhitzten Eisenerz, das sie aus dem Boden gegraben haben, zusammen mit Holzkohle. Eisenoxid ist eine Verbindung aus zwei Elementen – Eisen und Sauerstoff. In der Holzkohle steckt das Element Kohlenstoff – wenn sie zusammen erhitzt werden, verbinden sich die Sauerstoffatome mit dem Kohlenstoff und lassen das Eisen zurück. Allerdings ist das Eisen verunreinigt und - nach heutigen Maßstäben - minderwertig, aber immer noch härter als Kupfer.
Das Periodensystem der Elemente ist eine Tabelle, in der die verschiedenen Elemente angeordnet sind. Die meisten davon wurde schon vor vielen Jahren entdeckt. Bis heute wurden 81 Elemente identifiziert, die natürlich vorkommen, und ungefähr 25 Elemente wurden künstlich vom Menschen erschaffen.
Die kleinsten Teilchen
BearbeitenDu hast schon viel über Chemie erfahren, auch ohne große Worte wie: Atome, Ionen, Moleküle, Elektronen und so weiter. Bis vor etwa 150 Jahren wussten selbst die Wissenschaftler nicht richtig über diesen Teil der Chemie Bescheid. Niemand hatte diese allerkleinsten Teilchen, aus denen Materie besteht, zuvor gesehen – dabei sind sie es doch, die für fast alles verantwortlich sind, was in der Chemie passiert. Atome sind die Grundbausteine der Chemie. Sie sind im Universum für alles die Basis. Du solltest dich erinnern, dass Materie aus Atomen zusammengesetzt ist. Atome und das Studium der Atome sind eine Welt für sich. Atome sind der Schlüssel, um zu beschreiben, warum es verschiedene Elemente gibt und warum sie so miteinander reagieren, wie sie es tun. Sie erklären auch, warum das Periodensystem der Elemente genau so aufgebaut ist.
Heute können wir uns Atome ansehen, wenn wir ein Gerät benutzen, das „Raster-Tunnel-Mikroskop“ heißt. Damit kann man Dinge sehen, die sogar noch Millionen mal kleiner sind als das, was uns normale Mikroskope zeigen. Unter dem Raster-Tunnel-Mikroskop sehen Atome aus wie kleine verschwommene Kugeln.
Atome = Basisbausteine
Bearbeiten
Atom heißt auf griechisch ἄτομος, átomos, und bedeutet „das Unteilbare“. Die Chemiker glaubten vor 200 Jahren, dass die Grundbausteine der Chemie unteilbar seien und nannten sie "Atome".
Seit Beginn des 20. Jahrhunderts wissen sie, dass sie aus kleineren Teilchen zusammengesetzt sind. Der Name "Atom" ist zwar nicht zutreffend, wird aber weiterhin benutzt.
Atome bestehen aus Protonen, Neutronen und Elektronen. Darum werden diese auch subatomare Teilchen genannt. Atome unterscheiden sich voneinander durch die Anzahl der Protonen, Neutronen und Elektronen.
Die Physiker untersuchen diese subatomaren Teilchen. Einige von ihnen, wie Protonen und Neutronen, bestehen aus kleineren Strukturen (Quarks genannt), bei anderen (z. B. Elektronen) ist es nicht gelungen, sie weiter zu teilen.
Aufbau
Bearbeiten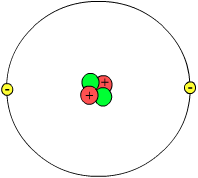

Nach dem heutigen Verständnis besteht das Atom aus zwei Teilen, dem Atomkern (oder Nukleus) und einer Atomhülle (Elektronenwolken oder Orbitale). Der Nukleus besteht aus Protonen und Neutronen (auch Nukleonen genannt). Mit dem Atomkern beschäftigen sich Teilchen-Physiker.
Die Chemie eines Elementes, also ob es bei Zimmertemperatur fest, flüssig oder gasförmig ist, und was passiert, wenn verschiedene Atome zusammentreffen, hängt nur von den Vorgängen in der Atomhülle (und damit von der Anzahl der Protonen und Elektronen) ab.
Der Atomkern ist im Vergleich zur Atomhülle sehr klein: wenn du den Rand der Atomhülle mit den obersten Plätzen eines Fußballstadions vergleichst, wäre der Atomkern nur so groß wie ein Reiskorn am Anstoßpunkt. Um den Atomkern herum ist also viel Raum, in dem sich elektromagnetische Felder befinden.
In den neutralen Elementen befinden sich gleich viel Elektronen und Protonen. Elektronen sind negativ geladen, Protonen sind positiv geladen. Die Anzahl an Protonen bestimmt, welches Element du vor dir hast. Im Periodensystem sind die Elements nach ihrer Protonen-Anzahl geordnet. Das erste Element (Wasserstoff) hat ein Proton, das zweite Element (Helium) hat zwei Protonen, usw. Die Elemente können eine unterschiedliche Anzahl von Neutronen besitzen. Neutronen haben keine Ladung, aber sie helfen, den Kern zu stabilisieren. Die positiven Ladungen im Kern würden sich alleine voneinander abstoßen, und der Kern könnte auseinanderfallen. Bei der richtigen Neutronenanzahl sind die Elemente stabil, wenn zu viele oder zu wenig Neutronen im Kern sind, ist er instabil und zerfällt. Dabei senden sie radioaktive Strahlung aus. Elemente mit gleichen Protonenzahlen und unterschiedlicher Anzahl von Neutronen nennt man Isotope. Wasserstoff zum Beispiel hat 3 Isotope, eines mit einem Neutron, eines mit zwei und eines mit drei Neutronen. Sie haben alle nur ein Proton und sind deshalb alle Wasserstoff-Isotope.
Die Elektronenwolke umgibt den Kern. Früher glaubten manche Wissenschaftler, die Elektronen bewegen sich um den Kern und werden von ihm angezogen, weil sie negativ geladen sind. In ihren Modellen umkreisen Elektronen den Kern wie die Planeten die Sonne, auf ganz bestimmten, festgelegten Bahnen. Heute wissen wir, dass das nicht stimmt. Das Bohrsche Atommodell konnte nicht alle Beobachtungen erklären und wurde zum Orbitalmodell erweitert.
Kleine Objekte wie Elektronen, Atome oder Moleküle besitzen Eigenschaften, die wir aus unserer Alltagswelt nicht kennen. Die Quantenmechanik beschreibt diese Eigenschaften.
Über Atome
BearbeitenDie Atome der verschiedenen chemischen Elemente besitzen eine unterschiedliche Zusammensetzung. Ihr innerer Aufbau hilft uns, die Elemente zu ordnen:
- 1. Element: 1 Proton und 1 Elektron
- 2. Element: 2 Protonen und 2 Elektronen
- 3. Element: 3 Protonen und 3 Elektronen
- 4. Element: 4 Protonen und 4 Elektronen
- usw.
Alle Elemente haben einen Namen und eine Abkürzung (Formelzeichen). Diese Formeln müssen Chemiker auswendig lernen:
- 1. Element: Wasserstoff, H: 1 Proton und 1 Elektron
- 2. Element: Helium, He: 2 Protonen und 2 Elektronen
- 3. Element: Lithium, Li: 3 Protonen und 3 Elektronen
- 4. Element: Beryllium, Be: 4 Protonen und 4 Elektronen
- usw.
Vor dem Elementsymbol stehen manchmal eine tiefgestellte Zahl:
1H
Die tiefgestellte Zahl nennt man Ordnungszahl. Sie entspricht der Zahl der Protonen und damit auch der Zahl der Elektronen.
(Wasserstoff, H hat (immer) 1 Proton und 1 Elektron)
Vor dem Elementsymbol steht manchmal eine hochgestellte Zahl:
3H
Die hochgestellte Zahl nennt man Massenzahl. Sie entspricht der Summe von Protonen und Neutronen.
(Wasserstoff H hat immer 1 Proton und folglich 2 Neutronen: 1+2=3 )
Elemente, die eine unterschiedliche Anzahl von Neutronen besitzen, nennt man Isotope. Elemente können (theoretisch) beliebig viele Neutronen haben:
- 1. Element: 1 Proton und 1 Elektron und (theoretisch) beliebig viele Neutronen
- 2. Element: 2 Protonen und 2 Elektronen und (theoretisch) beliebig viele Neutronen
- 3. Element: 3 Protonen und 3 Elektronen und (theoretisch) beliebig viele Neutronen
- 4. Element: 4 Protonen und 4 Elektronen und (theoretisch) beliebig viele Neutronen
- usw.
"Theoretisch" bedeutet hier, das man auf dem Papier eine beliebige Zahl von Neutronen aufschreiben kann. "Praktisch", also in der Natur kommen nur wenige Kombinationsmöglichkeiten vor:
- 1. Element: 1 Proton und 1 Elektron und 0 oder 1 oder 2 Neutronen
- 2. Element: 2 Protonen und 2 Elektronen und 1 oder 2 oder 3 oder 4 Neutronen
- 3. Element: 3 Protonen und 3 Elektronen und 3 oder 4 Neutronen
- 4. Element: 4 Protonen und 4 Elektronen und 3 oder 4 oder 5 oder 6 oder 7 Neutronen
- usw.
</noinclude>
Was ist ein Molekül?
BearbeitenEin Molekül besteht aus zwei oder mehreren Atomen, welche durch eine Chemische Bindung zusammengehalten werden. Moleküle können aus gleichen oder unterschiedlichen Elementen bestehen.
Wo findet man Moleküle?
Bearbeiten
Fast alles besteht aus Molekülen, auch die Luft, die du atmest, und das Wasser, das du trinkst! In der Luft, bewegen sich die Sauerstoff-Atome meistens zusammen mit einem Partner (2 x O = O2), genau wie Wasserstoff (2 x H = H2) und Stickstoff (N2). Wasser besteht aus zwei Wasserstoff-Atomen und einem Sauerstoff-Atom (H2O).
Wie verbinden sich Atome?
BearbeitenAtome können miteinander verbinden und so Moleküle und Verbindungen bilden. Eine Verbindung ist ein Molekül, das mehr als ein Element enthält.
Wie verbinden sie sich? Es hat mit elektrischen Ladungen zu tun. Verschiedene elektrische Ladungen ziehen sich ähnlich wie Magnete an. Der Kern eines Atoms ist positiv geladen und die Elektronen negativ. Atome bilden wegen ihrer Elektronen Moleküle. Besonders Elektronen die in den äußeren Orbitalen sitzen bestimmen welche Atome sich zu Molekülen binden. Elektronen können Atome auf mehrere Arten verbinden:
Wenn ein Atom allein ist, also bevor es mit irgendetwas reagiert hat, hat es die gleiche Anzahl von Protonen und Elektronen. Mit einer gleichen Anzahl von Protonen und Elektronen, heben sich die Ladungen gegenseitig auf und das Atom hat keine Ladung. Elektronen können aber wandern. Dort wo sie hinwandern befindet sich nun eine negative Ladung und dort wo sie herkommen eine positive. Jetzt kann das Atom andere Atome anziehen.
Ionische Bindungen
BearbeitenManchmal verfügen Atome nicht über eine gleiche Anzahl von Protonen und Elektronen. Wenn ein Atom ein Elektron verliert, hat das Atom eine positive Ladung und wenn ein Atom ein Elektron erhält, eine negative Ladung. Atome mit einer Ladung heißen Ionen. Ionen mit positiver Ladung und Ionen mit negativer Ladung ziehen einander an. Du kannst sie dir wie zwei Magneten vorstellen.
Wenn aber ein Atom eines seiner Elektronen an ein anderes Atom abgibt, werden die beiden Atome zu Ionen. Diese Ionen verbinden sich auch und werden durch Anziehungskräfte zusammengehalten. Diese Bindungen heißen Ionen-Bindungen, weil ein Atom, das weniger oder mehr Elektronen hat als Protonen, Ion genannt wird. Kochsalz ist eine solche Ionen-Bindung und es ist ziemlich hart. Es besteht aus Natrium- und Chlorionen. Das explosive Natrium verliert ein Elektron an das Chlorgas, das in seiner natürlichen Form gefährlich giftig ist. Durch diese Reaktion entsteht ein neuer Stoff, der harmlos ist.
Was sind Ionen?
BearbeitenIonen sind positiv oder negativ geladene Elemente. Ein neutrales Element besitzt gleich viele Elektronen wie Protonen. Ionen sind geladen, wenn sie ein oder mehrere Elektronen aufgenommen oder abgegeben haben. Ein positiv geladenes Ion (= hat Elektronen abgegeben) nennt man Kation. Ein negativ geladenes Ion (= hat Elektronen aufgenommen) nennt man Anion.
Kovalente Bindungen
BearbeitenNicht alle Verbindungen entstehen dadurch, dass Elektronen weggegeben werden. Atome können Elektronen gemeinsam benutzen. Die gemeinsam benutzten Atome werden von beiden Atomkernen angezogen. Dies nennt man eine kovalente Bindung. Wenn beide Atome die Elektronen gleich stark anziehen spricht man von einer rein kovalenten Bindung. Solche Bindungen gibt es in gasförmigem Wasserstoff, Sauerstoff, oder Stickstoff. Wenn sie verschieden stark sind von einer polar kovalenten Bindung.
Einige Atome haben eine hohe Anziehungskraft, wie Sauerstoff, Stickstoff, Chlor und Fluor. Einige haben eine geringe Anziehungskraft wie Metalle, Kohlenstoff und Wasserstoff. Elemente mit gleicher oder ähnlicher Anziehungskraft bilden rein kovalente Bindungen.
Metallbindung
BearbeitenEine etwas andere Art des Teilens, findet man bei den Metallen: Viele Atome teilen sich Elektronen. Sie können rasch Elektronen abgeben oder aufnehmen. Bildlich gesehen umspült ein Meer von Elektronen Inseln von Atomkernen. Metallischen Bindungen existieren nur in Metallen, wie z. B. Aluminium, Gold, Kupfer.
Da die Elektronen wandern können, leiten Metalle den elektrischen Strom. Dabei entstehen Ladungsunterschiede, die das Metall fest und biegbar machen. Auch der silberne und goldene Glanz der Metalle beruht auf den Bewegungen der Elektronen.
In diesem Experiment kannst Du kristalline Süßigkeiten herstellen, die man essen kann! Es dauert ungefähr vier bis sieben Tage.
Sicherheit
BearbeitenWie alle Versuche solltest du auch diesen Versuch mit deinen Eltern besprechen, bevor du beginnst.
Dieses Experiment beinhaltet:
- Sehr heißes Wasser – Es kann die Haut verbrennen. Hol dir Hilfe von einem Erwachsenen wenn du mit kochendem Wasser experimentierst.
- Glas kann zerspringen, wenn man heißes Wasser hinein gießt. Verwende deshalb bruchsichere Gläser wie Teegläser, Kaffeebecher oder Marmeladengefäße. Sie sollten aus Glas sein, damit du das Kristallwachstum beobachten kannst.
- Lebensmittelfarbe – Du kannst mit Lebensmittelfarben die Kristalle färben. Allerdings macht Lebensmittelfarbe Flecken auf der Kleidung. Benutze eine Schürze und wische verschüttete Farbe sofort auf.
Was du benötigst
Bearbeiten- Einen sehr sauberen Becher, der heiße Flüssigkeiten enthalten kann, ohne zu springen
- Einen Krug oder einen Topf mit einem Ausguss, der heiße Flüssigkeiten enthalten kann
- Einen Topflappen
- Ein langes Stück sauberer Baumwolle, eine Schnur oder einen Faden
- Drei bis vier Tassen Zucker
- Etwas mehr als eine Tasse heißes Wasser
- Einen Stützstab, wie einen eckigen Bleistift (runde Stifte rollen und halten den Faden schlecht)
- Eine Büroklammer
- Eine Untertasse
- Eine Schere
- Papierhandtücher
- Lebensmittelfarbe (nicht unbedingt erforderlich)
Experiment
BearbeitenFühre mit Erlaubnis deiner Eltern folgendes Experiment durch:
Schritt 1: Vorbereitung
Bearbeiten- Binde die Schnur um den Bleistift. Die Schnur sollte so lang sein, dass sie fast den Boden berührt.
- Befestige die Büroklammer am Ende des Fadens. Das Gewicht spannt den Faden.
- Lege den Bleistift auf den Rand des Glases. Überprüfe noch einmal die Länge.
- Nimm ihn wieder raus und lege ihn neben das Glas.
Schritt 2: Lösung herstellen
BearbeitenAm besten, du machst es gemeinsam mit deinen Eltern.
- Nimm etwas mehr Wasser, als in das Glas passt.[1]
- Wasser aufkochen. Denk daran, kochendes Wasser ist gefährlich!
- Gieße vorsichtig die Flüssigkeit in einen Topf oder in einen Krug mit Ausguss.
- Füge einen Esslöffel Zucker dazu und rühre um, bis der Zucker sich auflöst (verschwindet).
- Füge erneut einen Esslöffel Zucker dazu und löse ihn auf.
- Wiederhole dies, bis der Zucker sich nicht mehr auflöst. Dies erkennst du daran, dass nach dem Umrühren noch Zucker am Boden des Behälters liegen bleibt. Dies wird als gesättigte Lösung bezeichnet.
- (Wenn Du farbige Zuckerkristalle herstellen möchten, füge ein paar Tropfen Lebensmittelfarbe hinzu. Denk daran, eine Schürze zu tragen!)
Schritt 3: Einfüllen
Bearbeiten
- Gieße nun vorsichtig deine Lösung in das Glas. Achtung: Die ungelösten Körner sollten nicht ins Glas gelangen.[2]
- Lege den Bleistift auf den Rand des Glases. Der Faden soll in der Mitte des Behälters nach unten hängen.
Schritt 4: Fertig stellen
Bearbeiten- Warte zehn Minuten, bis sich das Glas abgekühlt hat.
- Stelle das Glas an einen geeigneten Ort, wo es ungestört stehen bleiben kann.
- Decke es mit der Untertasse ab, damit kein Staub hineinfällt.
- Warte vier bis sieben Tage.
Schritt 5: Beobachten
Bearbeiten- Betrachte jeden Tag das Glas. Nach zwei Tagen sollten die ersten Kristalle zu sehen sein.
Schritt 6: Genießen
Bearbeiten- Zieh den Faden, der mit Zuckerkristallen bedeckt ist raus.
- Trockne die Süßigkeiten auf einem Teller. Du kannst sie aber auch sofort essen.
- Viel Spaß!
Was ist passiert?
Bearbeiten
In diesem Experiment stellst du zuerst eine gesättigte Zuckerlösung her. Viele Zuckermoleküle sind nun zwischen den Wassermolekülen verteilt und bewegen sich schnell umher. Die Moleküle bewegen sich langsamer, wenn die Lösung sich abgekühlt. Zuckermoleküle die den Faden berühren, können daran „festkleben“. Dieser Vorgang wird als Keimbildung bezeichnet. Zuckermoleküle ziehen sich gegenseitig an. Deswegen lagern sich weitere Zuckermoleküle am „Keim“ an und bilden so einen Zuckerkristall.
Dieser Vorgang läuft auch in der natürlichen Welt ab. Gesteine wie Granit werden in Kammern unter der Erde gebildet, wenn sich sehr langsam flüssiges Gestein oder Magma abkühlt. Sobald sich das Magma abkühlt, fangen die Mineralien im Gestein langsam an zu kristallisieren. Wenn Du ein Stück Granit betrachtest sieht du schwarze, graue und pinkfarbene Sprenkel. Jeder Sprenkel im Granit ist ein Kristall, dass über Tausende von Jahren gewachsen ist. In manchen Gesteinen findest Du auch Hohlräume, in denen größere Kristalle gewachsen sind, wie beispielsweise die violetten Amethyste.
Atome ordnen sich
Bearbeiten- In Kristalle ordnen sich Atome so an, dass sich geometrische Körper bilden: Würfel, Parallelogramme, Pyramiden usw.
- Um die Anordnung der Atome in einem Kristall bestimmen zu können, werden sie mit Röntgenlicht bestrahlt. Dies ist auch mit komplexen biologischen Molekülen möglich. Biochemiker haben daher Verfahren entwickelt, um besonders reine Kristalle zu züchten.
- Von vielen komplexen organischen Verbindungen ist heute bekannt, aus welchen Elementen sie bestehen und wie die einzelnen Elementen sich miteinander verbunden haben.
Im nächsten Kapitel kannst du auch noch Salzkristalle züchten. Die schmecken aber nicht so gut!
- ↑ Dann kann beim mischen etwas Wasser verdunsten und man kann das Glas trotzdem gut voll machen. Wenn etwas übrig bleibt, kann man den Rest als „Teezucker“ verwenden.
- ↑ Wenn das passiert, dann wachsen dort die „Süßigkeiten“ und die eigentlichen „Süßigkeiten“ werden kleiner.
Lösung oder Gemisch ?
Bearbeiten
Bevor wir uns mit Lösungen beschäftigen, überlegen wir uns, was Lösungen von anderen Mischungen unterscheidet. Die Wissenschaft sagt: „Lösungen sind ein homogenes System, in dem die Moleküle völlig gleichmäßig verteilt sind.“ Klingt kompliziert, oder? Es gibt noch andere Gemischarten, machen wir mal zwei Experimente:
Versuch mal, etwas Sand in einem Glas mit viel Wasser aufzulösen – es wird nicht klappen. Du kannst noch so viel umrühren, der Sand verschwindet nicht. Wenn du das Ganze durch einen Kaffeefilter laufen lässt, bleibt der Sand im Filter, und das Wasser wird unten rauslaufen (Frag aber deine Eltern, bevor du es zu Hause ausprobierst, irgendjemand muss das auch wieder saubermachen!)
Nun schütten wir etwas Salz (etwa ein oder zwei Esslöffel) in ein Glas mit Wasser. Jetzt noch etwas umrühren – und das Salz ist verschwunden. Aber es ist nicht wirklich weg! Das Wasser schmeckt jetzt salzig, oder? Das Salz hat sich sehr, sehr fein im Wasser verteilt – es hat sich aufgelöst.
Was ist nun ein „homogenes System“? – Das bedeutet, dass jeder Teil des Systems, jeder noch so kleine Tropfen, völlig gleich ist, in seinen Eigenschaften und in seiner Zusammensetzung. Wasser und Salz sind jetzt EIN Stoff.
Das Gegenteil heißt „heterogenes System“. – Das Wasser hat den Sand nicht aufgelöst. Du kannst die Sandkörner noch gut erkennen. Oder sagen wir, es gibt eine Grenze zwischen Sandkorn und Wasser. Diese Grenze heißt Grenzfläche. Auf der einen Seite der Grenze finden wir Sand, auf der anderen Wasser. Bei Lösungen gibt es diese Grenzfläche nicht.
Was gibt es für Lösungen?
BearbeitenEs gibt sehr viel Arten von Lösungen. Feste Dinge können sich in flüssigen auflösen (Salz und Wasser). Flüssigkeiten können auch Gase lösen. Willst du wissen, wie Fische im Wasser atmen? – Mit ihren Kiemen ziehen sie Sauerstoff aus dem Wasser. Man kann auch zwei feste Stoff ineinander auflösen. Dazu muss man sie erst schmelzen und mischen. Wenn sie wieder kalt und fest sind, sind sie ein Stoff. Das wird mit Metallen so gemacht, und das passiert mit Steinen in einem Vulkan.
Was passiert beim „Auflösen“?
BearbeitenFragst du dich, was mit dem Salz in dem Wasserglas passiert ist? Wie gesagt, es ist jetzt sehr, sehr fein verteilt. Das Salz ist in sehr kleine Stücke zerfallen, die nun überall gleichmäßig im Wasser herumschwimmen. Willst du wissen wie groß diese Stückchen sind? – Hast du schon mal etwas von Atomen und Molekülen gehört? (Darüber gibt es ein extra Kapitel)
Atome sind Millionen mal kleiner als ein Millimeter. Sie sind die kleinsten Bausteine, aus den Materie besteht. Moleküle sind Verbindungen dieser Atome. Ein Salz-Molekül besteht aus einem Natrium-Atom und einem Chlor-Atom, in der Chemie heißt Salz deshalb Natriumchlorid. Als sich die beiden Atome verbunden haben, ist noch mehr passiert: Das Natrium-Atom hat eines seiner Bausteine, nämlich ein Elektron, an das Chlor-Atom abgegeben. Dadurch sind sie zu Ionen geworden.
Wenn sich das Salz im Wasser auflöst, bricht die Ionen-Verbindung auf. Das Natrium-Ion schwimmt frei im Wasser, genauso wie das Chlor-Ion mit dem Elektron vom Natrium.
Was kann alles Lösungen beeinflussen?
BearbeitenDie Fähigkeit eines Stoffes (z.B. Salz), sich in einem Lösungsmittel (Wasser) aufzulösen, heißt Löslichkeit. Es gibt viele Möglichkeiten, die Löslichkeit zu beeinflussen. Temperatur ist ein ganz wichtiger Faktor. Je heißer das Wasser ist, um so mehr Salz kann sich darin auflösen, aber um so weniger Gase können gelöst werden. Wenn Wasser in einem Topf zum Kochen gebracht wird, fängt es bei 50 bis 60 °C an, stark zu blubbern. Was da blubbert, das sind gelöste Gase, die sich nicht mehr im Wasser halten können. Noch bevor das Wasser richtig zu kochen anfängt, ist auf einmal Ruhe, alle Gase sind aus dem Wasser entwichen.
Am besten, du machst es gemeinsam mit deinen Eltern.
Auch der Luftdruck ist wichtig: Je höher der Druck ist, umso mehr Gase können gelöst werden. Das kannst du sehr schön bei einer Flasche mit Mineralwasser oder Limonade mit Kohlensäure beobachten: Solange die Flasche zu ist, herrscht darin ein etwas höherer Druck als außerhalb. Wenn du den Deckel aufmachst, zischt es, der Druck entweicht – und weil der Druck jetzt weg ist, können die Gase der Kohlensäure aus dem Getränk entweichen. Das siehst du an den vielen Bläschen, die plötzlich aufsteigen.
Ein Experiment: Salzkristalle züchten
Bearbeiten
Was brauchen wir?Bearbeiten
Wie wird es gemacht?Bearbeiten
Was passiert?BearbeitenDas Wasser wird nach und nach verdunsten, und weil immer weniger Wasser da ist, wird das Salz wieder zu festen Salzkristallen. Kristalle haben eine feste Struktur, bei Kochsalz ist das ein Würfel. Weil das Salz viel Zeit zur Kristallisation hat, werden schöne, große Kristalle wachsen. Nach einem Tag wirst du sehen, dass schon etwas weniger Wasser da ist. Dafür ist an der Wasseroberfläche eine Schicht Salz entstanden. In zwei oder drei Tagen wird das ganze Wasser verschwunden sein, und übrig bleiben die Salzkristalle. |
Es gibt viele Arten von Mischungen. Was unterscheidet sie von Lösungen und Verbindungen? Bei Verbindungen sind zwei oder mehr Elemente chemisch zu einem Stoff verbunden. In Lösungen sind die verschiedenen Stoffe zwar nicht chemisch verbunden, aber überall in der Lösung gleichmäßig verteilt. Bei Stoffgemischen sind zwei oder mehr Stoffe so miteinander vermischt, dass man immer noch eine Grenze zwischen den Stoffen finden kann – die Grenzfläche. Manchmal kannst du die Stoffe mit bloßem Auge unterscheiden, z.B. bei Matsch, wenn Sand und Wasser vermischt werden. Manchmal braucht man auch ein Mikroskop dazu, weil die Teilchen der Stoffe fein verteilt und winzig klein sind.
Legierungen
Bearbeiten
Die meisten Elemente sind Metalle, es gibt mehr als 80 davon. In der Technik werden aber so gut wie nie reine Elemente verwendet, sondern Legierungen. Das sind Mischungen von zwei oder mehr Metallen. Aber auch ein Metall mit einem Nicht-Metall kann eine Legierung sein. Durch das Mischen wird das Metall härter und fester.
Wie werden Legierungen hergestellt ?
BearbeitenDu fragst dich vielleicht, wie die Metalle vermischt werden. Dazu müssen die Metalle geschmolzen werden. Dazu braucht man sehr hohe Temperaturen. Bei einigen Metallen sind das ein paar hundert Grad, bei anderen 1500 °C, und noch mehr. Quecksilber hat mit -40 °C den niedrigsten Schmelzpunkt aller Metalle, es ist also bei Zimmertemperatur flüssig. Das Element Wolfram schmilzt erst bei unglaublichen 3500 °C!
Bronze
BearbeitenBronze ist die älteste Legierung, die wir kennen. Schon vor 5.000 Jahren wurde sie erfunden. Davor verwendeten die Menschen reines Kupfer für ihre Werkzeuge. Kupfer ist aber viel zu weich für Werkzeuge: die Klinge einer Axt wird schnell stumpf, oder die Axt verbiegt sich bei der Arbeit. Dann vermischten sie Kupfer (vielleicht zufällig) mit etwas Zinn. Das Ergebnis war die Legierung Bronze. Bronze ist viel härter und fester als reines Kupfer. Die Bronzezeit dauerte etwa 2.000 Jahre.
Stahl
BearbeitenVor 3.000 Jahren lernten die Menschen, aus Erz Eisen zu gewinnen. Damit begann die Eisenzeit.
Heute ist Stahl die wichtigste Legierung in der Technik. Interessanterweise ist Stahl eine Legierung aus Eisen und Kohlenstoff – einem Nicht-Metall. Kohlenstoff macht Eisen härter und fester, aber dafür bricht es schneller, kann weniger gut gebogen werden und rostet schneller. Diesen Nachteil gleichen andere Legierungselemente wieder aus.
- Wenn genug Chrom im Stahl ist, kann der Stahl rostfrei sein, denn Chrom verhindert, dass der Stahl rostet.
- Stahlteile können verzinkt werden. Der Stahl wird in geschmolzenes, 450 °C heißes Zink getaucht. Der Stahl überzieht sich mit einer Zinkschicht, die nur ein zehntel Millimeter dick ist. Das reicht aber, um den Stahl für Jahrzehnte vor Rost zu schützen.
Es gibt unglaublich viele Legierungen. Wie bei einem Kochrezept werden die Legierungselemente zusammen gemischt, etwas mehr hiervon, etwas weniger davon – und man erhält einen Werkstoff mit ganz anderen Eigenschaften.
Emulsionen
BearbeitenEine Emulsion ist ein Gemisch von zwei Flüssigkeiten, meistens Wasser und Öl, die sich eigentlich nicht mischen lassen. Milch ist zum Beispiel eine Emulsion, die aus Wasser, Kohlenhydraten, Eiweiß und Fett besteht. Auch Mayonnaise und die meisten Kosmetika sind Emulsionen.
Warum lassen sich Wasser und Öl nicht mischen ?
Bearbeiten
b) Winzige Öltröpfchen schwimmen jetzt im Wasser, jedes Tröpfchen ist von einer Grenzfläche umgeben.
Der Grund ist, dass Wassermoleküle und die von Öl durch verschiedene Kräfte zusammengehalten werden. Deshalb können sich Wassermoleküle nicht zwischen die Moleküle des Öls drängen und umkehrt. Das Ergebnis ist die Grenzflächenspannung.
Vielleicht hast du schon mal etwas von der Oberflächenspannung des Wassers gehört. Dadurch können einige Insekten übers Wasser laufen. Wenn du eine Nadel ganz vorsichtig auf eine Wasseroberfläche legst, wirst du sehen, dass sie schwimmt! Du kannst auch sehen, dass das Wasser ein wenig am Rand des Glases „hoch kriecht“. Der selbe Effekt sorgt für die Grenzflächenspannung zwischen zwei Flüssigkeiten.
Experiment 1
BearbeitenWas brauchen wir?
- Ein Glas mit Wasser (halbvoll)
- Salat- oder Pflanzenöl
- Etwas zum Umrühren
Wie wird´s gemacht?
- Schütte etwas Öl in das Wasser. Du wirst sehen, dass sich das Öl auf der Wasseroberfläche sammelt. Aus den Öltropfen wird sehr schnell eine einzige „Pfütze“. Du kannst ganz deutlich eine glatte Grenze zwischen Öl und Wasser sehen – das ist die Grenzfläche.
- Jetzt versuche, Wasser und Öl durch Umrühren zu vermischen. (Das geht mit einer Gabel ganz gut.) Du wirst sehen, dass danach viele kleine Tropfen im Wasser sind. Aber die Tropfen schwimmen alle nach oben und verbinden sich wieder zu größeren Tropfen. Wenn du lange genug wartest, ungefähr eine halbe Stunde, werden sich alle Tropfen zu einer einzigen Pfütze verbinden.
Was ist passiert?
- Wie gesagt, Wasser und Öl wollen sich nicht mischen lassen.
- Weil Öl leichter ist als Wasser, schwimmt es oben auf der Wasseroberfläche.
- Die Grenzflächenspannung versucht, die Grenze zwischen Öl und Wasser so klein wie möglich zu halten. Wenn zwei kleine Tropfen sich berühren, verschmelzen sie zu einem größeren.
Wie schafft man es, dass sich Öl und Wasser zu einer Emulsion verbinden?
BearbeitenEs gibt Stoffe, die Tenside oder Emulgatoren genannt werden. Tenside findest du in Waschpulvern und Spülmitteln, Emulgatoren in vielen Lebensmitteln. Sie lassen die Oberflächenspannung verschwinden. Wasser und Öl lassen sich zwar nicht verbinden, aber die winzigen Tröpfchen, die beim Umrühren entstehen, wachsen nicht mehr zusammen.
Experiment 2
BearbeitenWas brauchen wir?
- Das Glas vom ersten Experiment
- Spülmittel
- Etwas zum Umrühren
Wie wird´s gemacht?
- Hast du noch das Glas vom ersten Experiment? Wo sich Öl und Wasser getrennt haben?
- Gib einen kleinen Spritzer Spülmittel in das Glas ...
- ... rühr kräftig um und beobachte dann, was passiert.
Was ist passiert?
- Ohne das Spülmittel sind die Öltropfen nicht kleiner als drei oder vier Millimeter geworden.
- Mit dem Spülmittel sind sie nach dem Umrühren viel kleiner geworden, so dass man sie gerade noch sehen kann.
- Die Tröpfchen schwimmen zwar noch nach oben, aber sie verbinden sich nicht mehr zu großen Tropfen.
- In dieser Form bleiben die Tropfen noch tagelang erhalten.
- Dadurch vermischen sich Wasser und ÖL.
Suspensionen
BearbeitenWenn feste Stoffe in Flüssigkeiten schweben, nennt man dies eine Suspension. Kakao, Wandfarbe, Abwasser, Mörtel, Blut und vieles mehr sind Suspensionen.
Experiment 3
BearbeitenWas brauchen wir?
- Ein Glas mit Wasser (halbvoll)
- Erde
- Etwas zum Umrühren
Wie wird´s gemacht?
- Gib etwas Erde in das Wasser. Du wirst sehen, dass die Erde nach unten sinkt und das Wasser leicht trübe wird.
- Jetzt versuche, Wasser und Erde durch Umrühren zu vermischen. (Das geht mit einer Gabel ganz gut.) Du wirst sehen, dass das Wasser noch trüber wird. Aber die schweren Bestandteile der Erde (Sandkörner und Steine) lagern sich am Boden ab.
- Lass das Glas mit dem Wasser einen Tag stehen. Wenn du lange genug gewartet hast, wird das Wasser wieder klar sein. Auch kleinere Bestandteile des Wassers sind inzwischen zu Boden gesunken.
Was ist passiert?
- Weil Erde schwerer ist als Wasser, sammelt sich am Boden. (Die Ablagerung bezeichnet man als Sediment.)
- Die kleineren festen Bestandteile des Wassers benötigen Zeit, sich abzusetzen. (Diesen Vorgang nennt man Sedimentation.)
- Die Trübung im Wasser zeigt, dass sich Feststoffe darin befinden. (Dies nennt man eine Suspension.)
Chemische Verbindungen
BearbeitenAtome sind in der Lage sich miteinander zu verbinden. So entstehen Moleküle und chemische Verbindungen. Aber was passiert, wenn Atome sich verbinden, und was hält sie zusammen? Der Schlüssel zu diesen Fragen liegt im Inneren der Atome – bei winzig kleinen Teilchen, die noch 1000-mal kleiner sind als das Atom – bei den Elektronen.

Du musst dir ein Atom wie eine Zwiebel vorstellen – diese besteht aus mehreren Schalen – und ein Atom besitzt sogenannte Elektronenschalen. Auf jeder Schale haben unterschiedlich viele Elektronen Platz. Die äußerste Schale ist für das chemische Verhalten des Atoms ganz besonders wichtig. Diese Schale ist außer bei den Edelgasen bei keinem Element vollständig ausgefüllt, dort ist also noch Platz.
Hast du schon mal einen Blick auf das Periodensystem der Elemente geworfen? Ganz rechts findest du die Edelgase. Bei ihnen ist die äußerste Schale vollständig mit Elektronen gefüllt. Deshalb reagieren sie mit keinem anderen Element! Je weiter du in der Tabelle nach links gehst, um so weniger Elektronen findest du in der äußersten Schale, bis ganz links nur noch eins darin ist.
Diese Elektronen auf der äußersten Schale sind ganz besonders wichtig für alle chemischen Reaktionen eines Atoms, weil sie dabei von einem Atom zum anderen wandern. Wie stark der „Wille“ eines Atoms ist, fremde Elektronen an sich zu ziehen, heißt Elektronegativität.
Ionen-Bindung
BearbeitenWas passiert also, wenn sich Atome verbinden? Eine Möglichkeit ist, dass zwei Atome zu Ionen werden.
Ionen sind Atome, die eins oder mehrere ihrer Elektronen verloren oder neue Elektronen dazu gewonnen haben. Sie sind nun elektrisch geladen, weil die Zahl der Elektronen (–) und die Zahl der Protonen (+) jetzt unterschiedlich ist. Hat ein Atom Elektronen verloren, ist es positiv geladen. Wenn es Elektronen dazubekommen hat, ist es negativ geladen. Wir können uns ein Ion deshalb als eine Hälfte eines Magneten vorstellen.

Die kleinen Punkte sind Symbole für Elektronen
Also, ein Atom (sagen wir vom Element Natrium, Na) gibt ein Elektron ab. Was passiert mit dem verlorenen Elektron? Es wandert zum zweitem Atom (nehmen wir das Element Chlor, Cl), das sich an der Verbindung beteiligt. Diese Atom hat eine viel stärkere Anziehungskraft auf Elektronen als das erste. Das Chlor-Ion ist nun die zweite Hälfte unseres Magneten.
Wie die Plus- und die Minus-Pole von Magneten ziehen die Ionen sich nun gegenseitig an. Der entstandene Stoff heißt Natriumchlorid – auch bekannt als Kochsalz – das du sicher aus der Küche kennst.
So eine Bindung gehen Atome ein, die in ihrer Elektronegativität besonders weit auseinander liegen. Oder sagen wir, zwei Elemente, von denen das eine im Periodensystem der Elemente besonders weit links, und das andere besonders weit rechts liegt. (Aber nicht ganz rechts, das sind die Edelgase). Alle Salze und viele Mineralien werden durch diese Bindungs-Art gebildet. Übrigens ordnen sich die Atome meist in regelmäßigen Gittern an, so dass daraus Kristalle wachsen können.
Atombindung
BearbeitenNicht immer ist die Anziehungskraft eines Atom so groß, dass es ein Elektron ganz fest an sich bindet. Oft ist es so, dass sich die Atome die äußeren Elektronen teilen. Diese fliegen dann in einem großen Bogen um beide Atomkerne herum. So eine Verbindung heißt Atombindung oder kovalente Bindung.

Zwei Wasserstoffatome teilen sich ihre Elektronen
Bearbeiten
|
Bearbeiten
|
|
|
|
Metallische Bindung
BearbeitenDie metallische Bindung finden wir zwischen den Atomen eines metallischen Elements oder in Legierungen, wo verschiedene Metalle gemischt werden.
Metall-Atome haben allgemein keine hohe Anziehungskraft auf Elektronen, im Gegenteil: sie versuchen sie möglichst loszuwerden. Metalle können wie Salze zu Kristallen wachsen, denn ihre Atome ordnen sich in einem Gitter an. Dabei stoßen sie alle ihre äußeren Elektronen ab. Es entstehen freie Elektronen, die nicht mehr genau zu einem bestimmten Atom zugeordnet werden können.
Durch die freie Beweglichkeit der Elektron entstehen die typischen Eigenschaften der Metalle:
- Sie können Strom und Wärme sehr gut leiten.
- Sie glänzen und können spiegeln.
Elemente und Verbindungen
Bearbeiten
Einige Elemente reagieren sehr leicht (wie Fluor, Chlor, Sauerstoff) andere weniger leicht oder gar nicht (wie Helium und Neon).
Reaktionsträge Metalle nennt man "Edelmetalle" (wie Gold und Silber). "Halbedelmetalle" (wie Kupfer) sind nicht ganz so reaktionsträge sowie die Edelmetalle. Metalle die leicht reagieren nennt man "unedele Metalle" (wie Eisen).
Elemente der Steinzeit
Bearbeiten
| Verstehst Du nicht nur etwas Chemie sondern auch von der Wirtschaft? - Mal sehen. |
|---|
| In der Steinzeit kannte man bereits die Elemente Gold, Eisen, Silber und Kupfer.
Welches dieser Elemente war (bei gleichen Mengen) in der Steinzeit am teuersten, und welches am billigsten? Rate nicht, sondern überlege! |
In der Steinzeit benutzten die Menschen die Materialien, die sie in der Natur fanden: Steine, Holz, Metalle, Muscheln, Wolle usw. Und sie konnten Feuer machen. Mit Hilfe des Feuers konnten sie andere Materialien chemisch verändern: Sie konnten Essen kochen, und Tonerde zu Steingut (Tonwaren) brennen. (Mit Feuer umzugehen war das Urexperiment der Chemie.)
Aber in der Steinzeit konnten sei noch keine Metalle aus Erzen herstellen.
| Kannst du jetzt die Frage beantworten? |
|---|
| Welches der Elemente Gold, Eisen, Silber und Kupfer war in der Steinzeit am teuersten, und welches am billigsten?
....... war am teuersten, weil ......... |

Kupfer verwandelt sich leicht in Kupferverbindungen. Deshalb findet man auf der Erde nur wenig gediegenen Kupfer, also Kupfer als Metall. Häufiger findet man Kupfererze, das sind die farbigen Verbindungen des Kupfers. In der Steinzeit benutzte man sie als Farbstoffe. In den Töpferöfen der Steinzeit wurden Tonwaren mit den farbigen Kupfererzen bemalt und dann im Töpferofen stark erhitzt. Es bildet sich eine wasserfeste, glasartige Oberfläche. Mann nennt diesen Vorgang glasieren. (Nur in sehr guten Töpferöfen erreicht man die dafür erforderliche Temperatur. Deshalb findet man Glasuren erst am Ende der Steinzeit.)
Dann kam der Tag, an dem die Steinzeit endete ...
Elemente der Kupferzeit
Bearbeiten... und die Kupferzeit anfing. Ein Töpfer entdeckte im Töpferofen am Boden metallisch glänzendes Kupfer, das zwischen schwarzen Kohleresten und blauen Kupfererzen lag. Nun konnte in Experimenten herausgefunden werden, wie man aus Kupfererz und Kohle Kupfer gewinnen konnte. Und bald wurde in großen Mengen Kupfer hergestellt und das Metall Kupfer wurde viel billiger angeboten. Nun, in der Kupferzeit war es das billigste Metall.
| Zurück zur Frage: Wie war es in der Steinzeit? |
|---|
| Welches der Elemente Gold, Eisen, Silber und Kupfer war in der Steinzeit am teuersten, und welches am billigsten?
Wenn du deine Liste änderst, begründe dies. (in Gedanken) |
Elemente der Neuzeit
BearbeitenHeutzutage ist Gold am teuersten denn Gold ist sehr schwer und die schweren Metalle befinden sich vor allem im Erdkern. So tief können wir nicht graben. Gold kommt auch im Weltall nicht sehr häufig vor. Aber: Gold ist ein Edelmetall. Deshalb findet man Gold als Nugget aus Metall. Eisenerz findet man in riesigen Mengen, deshalb ist Eisen heute das billigste Metall. Leider rostet Eisen rasch, wie du an deinem Fahrrad sicher schon bemerkt hast. Wasser und Luft reichen aus, um dein Fahrrad in einen Rosthaufen zu verwandeln. Dabei verwandelt sich das Metall wieder in eine Verbindung. (Die wichtigste Legierung des Eisens wird Stahl genannt.)
| Letzte Korrekturmöglichkeit: |
|---|
| Wie war es in der Steinzeit ? |
Angebot und Nachfrage
BearbeitenÜbersteigt das Angebot die Nachfrage, so sinkt der Preis; übersteigt die Nachfrage, das Angebot so steigt der Preis. Diesen Vorgang nennt man Preisbildung.
Preise Anfang des 21. Jahrhunderts (billig) - Ein Kilo Eisen : 1 €; ein Kilo Kupfer : 10 €; ein Kilo Silber : 800 €; ein Kilo Gold : 40 000 €. - (teuer)

| "Preise" in der Steinzeit: |
|---|
| "Preise" in der Steinzeit:
(Für Produkte, die es nicht gibt, kann man auch keinen Preis nennen. In der Steinzeit gab es noch kein metallisches Aluminium und somit auch keinen Handelspreis für Aluminium.) teuer: ein Nugget aus Gold -- 25 Schafe (vermutlich) sehr teuer: ein Nugget aus Silber -- 50 Schafe (vermutlich) außerordentlich teuer: ein Nugget aus Kupfer -- 500 Schafe (vermutlich) Begründung: In metallischer Form findet man mehr Gold als Silber und nur selten Kupfer. Das liegt daran, dass Gold (Edelmetall) fast nicht mit anderen Elementen reagiert, Silber etwas stärker reagiert und Kupfer (Halbedelmetall) noch etwas stärker reagiert. Aber was ist mit dem Eisen? Auf der Erde rostet Eisen. In der Steinzeit dürfte es daher kein Eisen gegeben haben. (Wie war das? - Auf der Erde rostet Eisen. !!??!!) Aha! Im Weltall gibt es weder Luft noch Wasser. Es handelt sich um Eisenmeteoriten, also um Himmelsmetall. (Das nebenstehende Bild zeigt einen Eisenmeteoriten.)
|
Hast du dies gewusst?
Literatur
Bearbeiten- Gray, Theodore: Die Elemente, Fackelträger-Verlag, Köln 2009, ISBN 978-3771644352.
Periodensystem
Bearbeiten
Was ist das Periodensystem der Elemente?
Bearbeiten- Der Wissenschaft sind viele Elemente bekannt. Viele dieser Elemente haben ähnliche Eigenschaften. Wenn man sie nach ihren Eigenschaften in Gruppen einordnet, wird es einfacher, sie zu untersuchen und sie zu vergleichen. Aus diesem Grund ist die Einordnung der Elemente in Gruppen notwendig. Das Periodensystem der Elemente ist eine Möglichkeit die bekannten Elemente in Gruppen einzuteilen.
- Früher war es üblich, Elemente in zwei Gruppen einzuteilen, Metalle und Nichtmetalle. Aber man kannte auch Elemente, die Eigenschaften von Metallen und Nichtmetallen aufzeigten. Man nannte sie Halbmetalle.
Die Geschichte des Periodensystems der Elemente
BearbeitenFrühgeschichte
Bearbeiten
- Einige Elemente sind den Menschen bereits seit der Antike bekannt. Es handelt sich dabei um Elemente, die in reiner Form in der Natur vorkommen und mit einfachen Mitteln gewonnen werden können. Das sind zum Beispiel Gold, Silber und Kupfer.

- Der Philosoph Aristoteles war der Überzeugung, daß alle Materie aus vier Elementen besteht. Diese vier Elemente sind Erde, Wasser, Luft und Feuer. Das erinnert an die vier Aggregatzustände (in dieser Reihenfolge): fest, flüssig, gasförmig und plasmaförmig. Er war auch der Ansicht, dass diese vier Elemente in neue Verbindungen umgewandelt werden und die uns umgebende Materie bilden.
- Hennig Brand war der erste, der ein neues Element entdeckte. Er war ein deutscher Kaufmann, der mit seiner Firma pleite gegangen war. Er suchte nach dem Stein der Weisen - einem Stein, der der Sage nach ein einfaches Metall in Gold verwandeln kann. Bis 1669 experimentierte er mit menschlichem Urin. Bei der Destillation erhielt er eine weiße, glimmende Substanz. Er nannte sie Phosphorus. Bis 1680 behielt er seine Entdeckung geheim. In diesem Jahr entdeckte Robert Boyle die Substanz erneut und Brand ging mit seiner Entdeckung an die Öffentlichkeit.
- Bis 1809 wurden 47 weitere Elemente entdeckt. Mit steigender Anzahl bekannter Elemente entdeckten Wissenschaftler Ähnlichkeiten in der Reaktion der Elemente. Anhand der beobachteten Reaktionen versuchten Sie die Elemente in Kategorien einzuteilen.
Antoine-Laurent de Lavoisier
Bearbeiten
- Antoine Lavoisier schrieb 1789 sein Buch "Elementare Abhandlung über die Chemie". Dieses Buch ist das erste moderne Chemiebuch. Es enthält eine Reihe von Elementen, die nicht weiter zerlegt werden können. Lavoisier beschreibt unter anderem den Sauerstoff, Stickstoff, Wasserstoff, Phosphor, Quecksilber, Zink und Schwefel. Diese Auflistung bildet den Grundstein für die heute bekannten Elemente. Seine Liste enthielt jedoch auch das Licht und Wärme. Lavoisier war der Meinung, dass diese Feststoffe sind. Viele führende Chemiker seiner Zeit schenkten den Ansichten Lavoisiers keine Beachtung. Jedoch war sein Buch über die Chemie sehr gut geschrieben und fand unter der jungen Generation viel Beachtung.
- Er unterschied die Elemente lediglich in "Metalle" und "Nichtmetalle". Diese Einteilung wurde jedoch nicht akzeptiert.
Alexandre-Emile Béguyer de Chancourtois
Bearbeiten
- Alexandre-Emile Béguyer de Chancourtois war ein französischer Geologe. Er ordnete die bekannten Elemente nach ihrem Atomgewicht an. Chancourtois erkannte, dass die Gewichtsunterschiede zwischen den Elementen immer gleich groß sind. Er leitete aus dieser Erkenntnis eine erste Periodische Tafel ab. Er ordnete die Elemente auf einer Spirale an, die sich um einen Zylinder wand. Dabei erkannte er, dass Elemente mit gleichen Eigenschaften untereinander zu liegen kamen. Zusätzlich zu den Elementen enthielt sein Diagramm noch Ionen und Verbindungen. Seine Ausführung erschien 1862. Er benutzte in der Hauptsache geologische und keine chemischen Ausdrücke und benutzte auch keine Diagramme. Aus diesem Grund wurde seine Arbeit wenig beachtet. Erst als Dimitri Mendeleev seine Arbeiten veröffentlichte, änderte sich das.
John Newlands
Bearbeiten- John Newlands war ein englischer Chemiker, der 1865 die bis dahin bekannten 56 Elemente in 11 Gruppen einordnete. Diese Gruppen teilte er nach ähnlichen physikalischen Eigenschaften ein. Dabei entdeckte er, dass viele sehr ähnliche Elemente sich in einem Atomgewicht um acht oder einem Vielfachen von acht unterscheiden. Mit seinem "Gesetz der Oktaven" stellte er diese Regelmäßigkeit in die Nähe der Musik. Seine Zeitgenossen machten sich deshalb über ihn lustig. Es dauerte noch 50 Jahre, bis Lewis seine "Theorie der Valenzen" veröffentlichte und damit die Wichtigkeit des Vielfachen der Acht erkannt wurde.
Die erste Periodische Tafel
Bearbeiten
- Dimitri Mendeleev entwickelte als erster eine Periodische Tafel der Elemente, die der heutigen Form sehr nahe kommt. Er ordnete die Elemente auf einer Tafel nach ihrem Atomgewicht an. Es wird über ihn gesagt, dass er auf langen Zugfahrten ein "chemisches Solitaire" spielte. Auf den Karten waren die Elemente und ihre unterschiedlichen Eigenschaften aufgelistet. Am 6.März 1869 reichte er sein Arbeit bei der russischen chemischen Gesellschaft ein. Der Name der Arbeit war "Die Abhängigkeit der chemischen Eigenschaften der Elemente vom Atomgewicht". Seine Tafel wurde in einer kleinen russischen Zeitschrift veröffentlicht. Wenig später wurde sie erneut veröffentlicht, dieses Mal in der deutschen Zeitschrift "Zeitschrift für Chemie". Er erstellte folgende Regeln:

- 1. Ordnet man die Elemente ihrem Atomgewicht entsprechend an, zeigen sie eine eindeutige Regelmäßigkeit in ihren Eigenschaften.
- 2. Elemente die hinsichtlich ihrer Eigenschaften sehr ähnlich sind, unterscheiden sich entweder kaum in ihrem Atomgewicht (z.B. Pt, Ir, Os) oder ihr Gewicht wächst gleichmäßig an (z.B. K, Rb, Cs).
- 3. Die Anordnung der Elemente oder von Elementgruppen in der Reihenfolge ihres Atomgewichtes entspricht ihren sogenannten Valenzen, ebenso wie ihren charakteristischen chemischen Eigenschaften. Dies zeigt sich unteranderem in der Gruppe Li, Be, Ba, C, N, O und Sn.
- 4. Diejenigen Elemente, die leicht flüchtig sind, haben ein geringes Atomgewicht.
- 5. Die Höhe des Atomgewichtes bestimmt den Charakter des Elementes, ebenso wie das Ausmaß eines Moleküls den Charakter einer Verbindung bestimmt.
- 6. Wir müssen mit der Entdeckung vieler neuer Elemente rechnen - zum Beispiel mit Elementen, die dem Aluminium und Silizium ähnlich sind. Deren Atomgewicht würde zwischen 65 und 75 liegen.
- 7. Das Atomgewicht eines Elementes sollte in manchen Fällen den Atomgewichten seiner benachbarten Elemente angepasst werden. Dementsprechend muss das Atomgewicht von Tellurium zwischen 123 und 126 liegen. Es kann nicht 128 sein.
- 8. Gewisse Eigenschaften der Elemente können vorhergesagt werden, wenn das Atomgewicht bekannt ist.
Vorteile
Bearbeiten- Mendeleev sagte die Entdeckung weitere Elemente voraus und ließ entsprechend Platz in seinem Periodensystem der Elemente. Diese Elemente waren Eka-Aluminium (heute Gallium), Eka-Boron (Scandium) und Eka-Silizium (Germanium). Als diese Elemente entdeckt wurden, konnten sie ohne Probleme eingeordnet werden.
- Er sagte die Eigenschaften sowohl dieser noch unbekannten Elemente als auch Verbindungen mit diesen sehr genau voraus.
- Er wies darauf hin, dass einige der damals angegebenen Atomgewichte nicht richtig waren.
- Er sah Lücken in seinem Periodensystem vor, um Abweichungen im Atomgewicht auszugleichen.
Nachteile
Bearbeiten- Es gab keinen Platz für die Isotope der Elemente.
- Seine Tafel enthielt keine Edelgase, da diese zu diesem Zeitpunkt noch nicht entdeckt waren. Sir William Ramsay fügte die Edelgase später als Gruppe 0 hinzu, was die bestehende Periodische Tafel nicht beeinträchtigte.
- Ohne das Wissen von Mendeleev arbeitete Lothar Meyer ebenfalls an einem Periodensystem. Er veröffentlichte seine Arbeit 1864. In seinem Periodensystem ordnete Meyer lediglich 28 Elemente nach ihren Valenzen an. Er kam nie auf die Idee, neue Elemente vorherzusagen oder die Atomgewichte bekannter Elemente zu korrigieren. Nur wenige Monate nach Mendeleev veröffentlichte er ein nahezu identisches Periodisches System. Einige Leute sehen Mendeleev und Meyer als gleichwertige Entdecker an. Andere Leute sind jedoch der Meinug, dass Mendeleev der wichtigere Entdecker ist, weil er die Eigenschaften der noch nicht entdeckten Elemente genau vorhergesagt hat. Auf jeden Fall beeindruckten die Vorhersagen Mendeleevs seine Zeitgenossen und wurden später bestätigt. Ein englischer Chemiker entwickelte 1864 ein Periodensystem, welches dem von Mendeleev sehr ähnlich sah.
Henry Moseley
Bearbeiten
- 1914 entdeckte Henry Moseley einen Zusammenhang zwischen der Wellenlänge von Röntgenstrahlen, die auf ein Element gerichtet waren und dem Atomgewicht diese Elements. Bis zu dieser Entdeckung waren die Atomnummern lediglich aufeinanderfolgende Nummern basierend auf dem Atomgewicht der Elemente. Es wurde erkannt, dass die Atomnummern eine experimentell nachweisbare Grundlage haben.
- Die Forschung von Moseley ergab ferner, dass es zu diesem Zeitpunkt keine bekannten Elemente mit den Atomnummern 43 beziehungsweise 61 gab. Diese beiden Elemente sind radioaktiv und kommen in der Natur nicht vor. Moseley sagte ebenfalls neue Elemente voraus.
Glenn T. Seaborg
Bearbeiten- Während des Manhattan-Projekts von 1944 hatte Glenn T. Seaborg erhebliche Schwierigkeiten, die beiden Elemente Americium und Curium zu isolieren. Er nahm an, dass diese beiden neuen Elemente einer neuen Serie an Elementen angehörten. Dieses würde auch die Unterschiede zwischen ihren tatsächlichen und den vorhergesagten Eigenschaften erklären. Entgegen dem Rat seiner Kollegen änderte er die Periodische Tafel von Mendeleev erheblich und fügte die Aktinoidenreihe hinzu.
Liste der chemischen Elemente
Bearbeiten
| 1 Wasserstoff H | 2 Helium He | 3 Lithium Li | 4 Beryllium Be | 5 Bor B | 6 Kohlenstoff C | 7 Stickstoff N | 8 Sauerstoff O |
| 9 Fluor F | 10 Neon Ne | 11 Natrium Na | 12 Magnesium Mg | 13 Aluminium Al | 14 Silizium Si | 15 Phosphor P | 16 Schwefel S |
| 17 Chlor Cl | 18 Argon Ar | 19 Kalium K | 20 Kalzium Ca | 21 Scandium Sc | 22 Titan Ti | 23 Vanadium V | 24 Chrom Cr |
| 25 Mangan Mn | 26 Eisen Fe | 27 Kobalt Co | 28 Nickel Ni | 29 Kupfer Cu | 30 Zink Zn | 31 Gallium Ga | 32 Germanium Ge |
| 33 Arsen As | 34 Selen Se | 35 Brom Br | 36 Krypton Kr | 37 Rubidium Rb | 38 Strontium Sr | 39 Yttrium Y | 40 Zirkonium Zr |
| 41 Nobium Nb | 42 Molybdän Mo | 43 Technetium Tc | 44 Ruthenium Ru | 45 Rhodium Rh | 46 Palladium Pd | 47 Silber Ag | 48 Kadmium Cd |
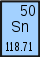
| 49 Indium In | 50 Zinn Sn | 51 Antimon Sb | 52 Tellur Te | 53 Jod I | 54 Xenon Xe | 55 Cäsium Cs | 56 Barium Ba |
| 57 Lanthan La | 58 Cer Ce | 59 Praseodym Pr | 60 Neodym Nd | 61 Promethium Pm | 62 Samarium Sm | 63 Europium Eu | 64 Gadolinium Gd |
| 65 Terbium Tb | 66 Dysprosium Dy | 67 Holmium Ho | 68 Erbium Er | 69 Thulium Tm | 70 Ytterbium Yb | 71 Lutetium Lu | 72 Hafnium Hf |
| 73 Tantal Ta | 74 Wolfram W | 75 Rhenium Re | 76 Osmium Os | 77 Iridium Ir | 78 Platin Pt | 79 Gold Au | 80 Quecksilber Hg |
| 81 Thallium Tl | 82 Blei Pb | 83 Wismut Bi | 84 Polonium Po | 85 Astat At | 86 Radon Rn | 87 Franzium Fr | 88 Radium Ra |
| 89 Aktinium Ac | 90 Thorium Th | 91 Protactinium Pa | 92 Uran U | 93 Neptunium Np | 94 Plutonium Pu | 95 Amerikium Am | 96 Curium Cm |
| 97 Berkelium Bk | 98 Kalifornium Cf | 99 Einsteinium Es | 100 Fermium Fm | 101 Mendelevium Md | 102 Nobelium No | 103 Lawrencium Lr | 104 Rutherfordium Rf |
| 105 Dubnium Db | 106 Seaborgium Sg | 107 Bohrium Bh | 108 Hassium Hs | 109 Meitnerium Mt | 110 Darmstadtium Ds | 111 Röntgenium Rg | 112 Copernicium Cn |
| 113 Nihonium Nh | 114 Flerovium Fl | 115 Moscovium Mc | 116 Livermorium Lv | 117 Tenness Ts | 118 Oganesson Og | 119 Ununennium Uue | 120 Unbinilum Ubn |
Liste der Elemente
BearbeitenWie sieht das Element aus, wie fühlt es sich an, wie riecht oder schmeckt es? Wie wurde es entdeckt? Wo kommt der Name des Elements her? Wo man findet dieses Element? Wozu brauchen wir dieses Element? Ist es gefährlich?
== Aluminium ==
 |
 |
Die Position von Aluminium im Periodensystem der Elemente.
|
Die Werte.
|
Aluminium ist ein Element, welches dafür bekannt ist, dass es sehr leicht ist und Korrosion widersteht. Aluminium wird in der Industrie zur Herstellung vieler Produkte verwendet und ist sehr wichtig für die Weltwirtschaft.
Wie sieht es aus, wie fühlt es sich an, wie riecht oder schmeckt es?
Bearbeiten
Aluminium ist ein relativ weiches, sehr leichtes Metall und ist normalerweise matt und silberfarben. Das matte Erscheinungsbild kommt daher, dass die Oberfläche des Aluminiums mit dem Sauerstoff der Luft reagiert und sich so eine dünne Schicht aus Aluminiumoxid bildet. Wenn diese Schicht fehlt, d.h. wenn das Aluminium keinem Sauerstoff ausgesetzt ist, ist Aluminium silberglänzend.
Wie wurde es entdeckt?
BearbeitenFriedrich Wöhler soll das Aluminium 1827 durch Mischen von wasserfreiem Aluminiumchlorid mit Kalium als Erster isoliert haben. Das Metall wurde jedoch schon 2 Jahre früher, allerdings in unreiner Form, von dem dänischen Physiker und Chemiker Hans Christian Ørsted hergestellt. Darum kann man Ørsted als Entdecker des Aluminiums bezeichnen.
Wo der Name herkommt
Bearbeiten1807 versuchte Sir Humphrey Davy Aluminium aus einem Mineral namens Alumini zu isolieren. Zuerst nannte er das Metall Alumium entschied sich dann aber 1812 für Aluminium.
- Wusstest du, dass...
- das Recyceln von Aluminium nur ein Zwanzigstel so viel Energie braucht wie das Produzieren von Aluminium aus Erz?
- Aluminium das häufigste Metall in der Erdkruste ist?
- Aluminum und Aluminium zwei verschiedene Namen für dieses Metall sind?
Wo man Aluminium findet
BearbeitenAluminium ist das häufigste Metall in der Erdkruste und das dritthäufigste Element überhaupt, nach Wasserstoff und Helium. Man kann es jedoch nicht als reines Metall in der Natur finden, sondern nur in Verbindung mit anderen Elementen als Aluminium-Erz. Durch den Bayer-Prozess kann man Aluminium aus dem Erz Bauxit gewinnen.
Wozu brauchen wir Aluminium?
Bearbeiten
Da Aluminium sehr leicht und stabil ist, wird es sehr oft verwendet. Es hilft uns, von Ort zu Ort zu kommen, da es Teil von Autos, Lastwagen, Flugzeugen, Fahrrädern, Raketen und vielem mehr ist.
Jeden Morgen, wenn du in den Spiegel schaust, ist das, was da reflektiert, sehr wahrscheinlich aus Aluminium gemacht. Die Töpfe und Pfannen, mit denen deine Familie kocht, können auch aus Aluminium sein. Sicher kennst du auch Alufolie, in der z.B. Essen eingepackt werden kann. Außerdem sind viele Getränkedosen aus Aluminium gemacht.
- Wenn man Aluminium mit Fe2O3 im richtigen Verhältnis vermischt, kann man Thermit herstellen.
- Thermit wird nach entzünden so heiß, dass das darin enthaltene Eisen schmilzt. Thermit benötigt keinen externen Sauerstoff, so das es auch unter Wasser reagiert. Eine häufige Anwendung ist das Verschweißen von Eisenbahngleisen.
Ist es gefährlich?
BearbeitenAluminium ist nicht gefährlich. Es ist durch eine Oxidschicht auf der Oberfläche geschützt, die sich sofort bildet, wenn das Metall der Luft ausgesetzt wird. Die Oxidschicht ist sehr stabil. Darum kann Aluminium für Küchenutensilien benutzt werden.
-
entzündbar
== Antimon ==
 |
 |
Die Position von Antimon im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Antimon aus? Wie riecht und schmeckt es? Und wie fühlt es sich an?
Bearbeiten
Antimon ist ein sprödes, bläulich silber-weißes Metall. Es ist geruchlos.
Wie es entdeckt wurde
BearbeitenAntimon ist seit der Antike bekannt. Der Entdecker und das Entdeckungsdatum sind unbekannt. Anfang des 18. Jahrhunderts hat der französische Chemiker Nicolas Lemery als erster eine wissenschaftliche Studie von Antimon und ihren Verbindungen durchgeführt. Seine Erkenntnisse wurden im Jahr 1707 veröffentlicht.
Wie Antimon zu seinem Namen kam
BearbeitenIm Name "Antimon" kommt die Kombination von zwei griechischen Wörtern: anti (d.h. gegen) und monos (d.h. allein). In Kombination bedeuten die beiden Worte "nicht allein".
Wo finden wir Antimon?
BearbeitenAntimon selbst kann in der Natur gefunden werden, meist als Mineral Stibnit (Sb2S3). Auch in Deutschland kann man es im Schwarzwald, im Fichtelgebirge, im Oberpfälzer Wald, im Odenwald und im Harz finden. Eine kleine Menge der Erdkruste besteht aus Antimon ( ca. 0.000002%).
Wozu brauchen wir Antimon?
BearbeitenAntimon wird zum Härten von Blei verwendet. Legierungen von Antimon werden verwendet, um beispielsweise folgende Produkte herzustellen: Batterien, reibungsarme Metalle, Metall- und Kabelummantelungen. Antimon wird auch bei der Herstellung von Kunststoffen und Chemikalien verwendet. Antimonverbindungen dienen der Herstellung von flammenfesten Materialien, Farben, keramischen Materialien, Glas und Keramik.
- Wusstest du, dass...
- Antimon, in Form von Stibnit, von den alten Ägyptern als schwarzer Lidschatten verwendet wurde?
Ist Antimon gefährlich?
Bearbeiten
Antimon ist gefährlich. Es wurde einst verwendet, um Parasiten zu töten. Viele Verbindungen von Antimon sind extrem giftig.
-
Achtung
== Argon ==
 |
 |
Die Position von Argon im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus, fühlt es sich an, schmeckt oder riecht es?
BearbeitenArgon riecht nicht, es ist ein unsichtbares Gas. Es hat keinen Geschmack und es ist nicht giftig.

Wann wurde es entdeckt?
BearbeitenDer schottische Chemiker Sir William Ramsay und der englische Chemiker Baron John Willian Strutt Rayleigh haben Argon im Jahr 1894 entdeckt.
Woher hat es seinen Namen bekommen?
BearbeitenDer Name Argon kommt von argos, dem griechischen Wort für träge. Es bekam diesen Namen, weil es kaum mit anderen Elementen reagiert. Ebenso wie Helium, Neon, Krypton und Xenon gehört es zu den Edelgasen.
- Wusstest du, dass...
- Argon schwerer als Luft ist?
- Argon das dritthäufigste Gas ist?
Wo kommt es vor?
BearbeitenArgon befindet sich in der Luft und ist ein Nebenprodukt der Herstellung von Sauerstoff und Stickstoff. Die Erdatmosphäre besteht zu 0,93% aus Argon.
Wofür braucht man es?
Bearbeiten
Argon kann benutzt werden um Feuer zu löschen, ohne dass dabei elektronische Geräte beschädigt werden. Es verdrängt den Sauerstoff, ohne den ein Feuer bekanntlich nicht brennen kann. Es wird beim Schutzgasschweißen sowie bei der Herstellung von Halbleitern benötigt. Außerdem braucht man es für die Herstellung von Leuchtstoffröhren.
Ist es gefährlich ?
BearbeitenNein, Argon ist normalerweise nicht gefährlich. Es kann gefahrlos eingeatmet werden, solange sich genügend Sauerstoff in der Luft befindet.
-
Gasflasche
== Arsen ==
 |
 |
Die Position von Arsen im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Arsen aus? Wie riecht und schmeckt es? Und wie fühlt es sich an?
BearbeitenArsen kann die Farben grau, gelb oder schwarz haben.


Wie Arsen entdeckt wurde:
BearbeitenSchon im Altertum handelt, heilt und mordet man mit Arsenverbindungen. Im Mittelalter hat Albertus Magnus reines Arsen hergestellt (ca. 1250)
Woher kommt der Name:
BearbeitenDer Name Arsen kommt von dem griechischen Wort arsenikón (αρσενικόν).
Wo findet man Arsen?
BearbeitenArsen kommt eigentlich überall in sehr winzigen Mengen vor. Es kommt selten in elementarer Form vor, häufiger jedoch in Mineralien und Verbindungen.
- Wusstest du, dass...
- auch winzige Arsenspuren im Mageninhalt von vergifteten Menschen nachgewiesen werden können?
- winzige Arsenspuren in Napoleons Haaren nachgewiesen wurden?
Wofür wird es verwendet?
BearbeitenArsen wird zu Bleilegierungen zugesetzt damit diese fester und besser gießbar werden. Da Arsen sehr giftig ist wurde es als Rattengift und Schädlingsbekämpfungsmittel verwendet.
Ist Arsen gefährlich?
Bearbeiten
Arsen ist sehr giftig und in geringen Mengen tödlich.
-
akut giftig
-
Umwelt
== Beryllium ==
 |
 |
Die Position von Beryllium im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Beryllium aus? Wie riecht und schmeckt es? Und wie fühlt es sich an?
BearbeitenBeryllium hat einen süßen Geschmack, ist aber sehr giftig. Es hat eine graue Farbe und ist leichtes Metall.
Wie Beryllium entdeckt wurde:
Bearbeiten
Beryllium wurde von Louis-Nicolas Vaquelin 1798 entdeckt. Er gewann es aus Edelsteinen.
- Wusstest du, dass...
- der grüne Smaragd und der blaue Aquamarin Beryllium enthalten?
- die Fenster beim Röntgenarzt aus Berylliumglas bestehen?
Woher kommt der Name:
BearbeitenBeryllium kommt von dem Wort Brille, da man im Mittelalter aus Berylliumkristallen Lupen und Brillen herstellte, die auch Zaubergläser genannt wurden.
Wo findet man Beryllium?
Bearbeiten
Reines Beryllium findet man nur sehr selten auf der Erde, aber es kommt in 30 verschiedenen Mineralien vor. Zum Beispiel in Bertrandit, Beryll und Chrysoberyll. Man findet es in großen Mengen in alten Sternen. Dies wurde entdeckt als Wissenschaftler in sechs alten Sternen am Rand der Milchstraße Beryllium fanden.
Wofür wird es verwendet?
Bearbeiten
Da Beryllium für ein Leichtmetall einen besonders hohen Schmelzpunkt besitzt, wird in der Flugzeug- und Weltraumtechnik verwendet. In Kupferlegierungen wird es zur Herstellung von funkenfreien Werkzeugen eingesetzt. Beryllium wird auch benutzt, um Neutronen herzustellen. Außerdem verwendet man es als Moderator in Kernreaktoren und Kernwaffen.
Ist es gefährlich?
BearbeitenBeryllium ist extrem giftig und es sind schon geringe Mengen tödlich. Süß, aber gefährlich.
-
akut giftig
.
== Blei ==
 |
 |
Die Position von Blei im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Blei aus? Wie fühlt es sich an?
BearbeitenBlei ist ein weiches und formbares Schwermetall. Wenn man es zerschneidet, glänzen die Schnittkanten silbrig, an der Luft läuft es aber schnell grau an.
Wie wurde es entdeckt?
BearbeitenBlei wird seit mindestens 7000 Jahren benutzt.
Woher kommt der Name?
BearbeitenBlei wurde von den Römern als Material für Gefäße, als Geschoss und als Siegel für Behälter benutzt. Ein anderes Wort für Siegel ist Plombe, daher kommt wahrscheinlich der lateinische Name Plumbum.
- Wusstest du, dass...
- "Bleistifte" niemals aus Blei gemacht wurden?
- es in Rom Wasserrohre aus Blei gibt, die seit 2000 Jahren Wasser zu den Wohnungen führen?
Wie wird Blei gewonnen?
BearbeitenBlei gewinnt man gewöhnlich aus Erzen.
Wofür benutzt man Blei?
Bearbeiten
Blei ist ein relativ häufiges Element und relativ billig herzustellen. Es hat eine hohe Dichte - das bedeutet dass es für die kleine Größe sehr schwer ist - also nimmt man Blei auch zum Herstellen von Hanteln oder als Schutz vor radioaktiver Strahlung. Deswegen muss dir der Arzt wenn er dich röntgt eine Bleischürze anziehen. Blei nimmt man auch, um daraus Munition herzustellen
Früher hat man Blei in einigen Farben verwendet, um sie schneller trocknen zu lassen oder damit sie länger halten. Jedoch ist der Dunst, den bleihaltige Farbe ausströmt giftig und darum nimmt man sie nicht mehr.
Blei wurde früher in das Benzin gemischt, um seine Oktanzahl und damit den Wirkungsgrad zu erhöhen. Die meisten Länder machen das nicht mehr, weil Blei den Katalysator (ein wichtiges Autoteil, das die Schadstoffe aus dem Abgas filtert) zerstört und somit Umweltprobleme verursacht.
Bleibatterien sind die ältesten aufladbaren Batterien und sind immer noch in Autos oder Booten eingebaut. Sie sind schwerer als die meisten anderen Batterien, aber sie versorgen die Geräte mit einem hohen Stromfluss und sind recht günstig.
Die wahrscheinlich bekannteste Verwendung von Blei sind die Kugeln für Gewehre und Pistolen oder die Bleigewichte an einer Angel.
Ist Blei gefährlich?
BearbeitenBleiverbindungen sind giftig, weil das Element Blei sich schnell mit anderen Atomen in deinem Körper verbindet. Das zerstört wichtige Zellfunktionen, was zu Krankheiten und, wenn sie nicht behandelt werden, zum Tode führt.
== Bor ==
 |
 |
Die Position von Bor im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Bor aus?
Bearbeiten
Das Halbmetall Bor kommt in fünf verschiedenen Variationen vor. Bor kann braun, grau, schwarz, rot oder rötlich sein.
Wie wurde es entdeckt?
BearbeitenIm Jahre 1808 waren die Voraussetzungen für die Entdeckung dieses Elements da und mehrere Chemiker stellten es unabhängig voneinander her: Joseph Gay-Lussac, Louis Jacques Thénard und Sir Humphry Davy.
Wo der Name herkommt
BearbeitenDas bereits im Altertum vielseitig verwendete Borax wird im Arabischen burag genannt. Aus Borax kann man Bor gewinnen.
- Wusstest du, dass...
- Borverbindungen in Raketentreibstoff und Feuerwerkskörpern verwendet werden?
- Bor das zweithärteste Element ist?
Wo wird es gefunden?
Bearbeiten
Borsalze werden in der Türkei, den USA und in Australien gefunden.
Wofür wird Bor verwendet?
BearbeitenBor wird für Raumfahrzeuge, Fasern und Halbleiter verwendet. Borcarbit wird wegen seiner Härte als Schleifmittel benutzt. Natriumperborat wird in großen Mengen in Waschmitteln eingesetzt. Borax wird für die Glasherstellung verwendet.
Ist es gefährlich?
BearbeitenBor ist ungiftig, aber einige Verbindungen schädigen das Erbgut und sind deshalb fortpflanzungsgefährdend. (Ungefährlich, kein GHS-Piktogramm.)
== Calcium ==
 |
 |
Die Position von Calcium im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Calcium aus und wie fühlt es sich an?
BearbeitenCalcium ist ein weiches graues Metall. Wenn es brennt, brennt es mit einer gelb-roten Flamme. Wenn es der Luft ausgesetzt ist, entwickelt es eine grau-weiße Beschichtung.
Wie wurde Calcium entdeckt?
BearbeitenCalcium ist schon seit dem Alten Rom bekannt. Die Römer entdeckten eine Möglichkeit, Calciumoxide herzustellen, durch Erhitzen von Kalkstein in einem Ofen. Allerdings dauerte es noch bis 1808, bis pures Calcium von Sir Humphrey Davy isoliert wurde.
Woher kommt der Name?
BearbeitenCalcium kommt von calcis, ein lateinisches Wort, welches Kalk bedeutet.

- Wusstest du, dass...
- feuchtes Calciumhydroxid zu Kalk wird, wenn es sich mit Luft verbindet? (Diese chemische Reaktion ist dieselbe, welche Zement erhärten lässt.)
- Calcium das häufigste Metall in Tieren ist? (Knochen bestehen aus Kalk.)
- Stalaktiten und Stalagmiten in erster Linie aus Calciumcarbonat bestehen? (So nennen Chemiker Kalk.)
Wo man Calcium findet
BearbeitenCalcium findet man nicht als ein pures Element, jedoch findet man es verbreitet in der Verbindung Calciumcarbonat (CaCO3). Viele Gesteine, wie Kalkstein, Marmor, Kreide und Calcit enthalten diese Substanz. Kalksteinhöhlen sind ein großes Beispiel dafür, wo man Calcium finden kann. Muschelschalen und Schneckenhäuser bestehen hauptsächlich aus Calciumcarbonat. Eierschalen sind ebenfalls zum größten Teil aus dieser Masse.
Calcium wird auch in vielen Nahrungsmitteln zu bedeutenden Mengen gefunden. Molkereiprodukte wie Milch, Joghurt und Käse enthalten Calcium. In grünem Gemüse steckt auch oft Calcium drin. Brokkoli, Kohlblätter, Mandeln, Sesam und Bohnen, alle enthalten bedeutende Mengen an Calcium.
Wofür braucht man Calcium?
Bearbeiten

Calcium ist wichtig für unseren Körper. Es macht unsere Knochen und Zähne stark und hilft unseren Muskeln and Gehirnzellen zu arbeiten.
Calcium ist eine wichtige Substanz in der Bauindustrie, denn Calciumhydroxid (Ca(OH)2 wird in Zement und Mörtel gebraucht. Calciumcarbonat wird ebenso in Plastik und in Kleber als ein Füllstoff verwendet. Weil Calciumoxid (CaO2) Säure neutralisiert, kann es benutzt werden, um den Effekt des sauren Regens in Flüssen und Seen zu vermindern. Calcium ist zudem häufig in Tabletten gegen Sodbrennen und Magensäure zu finden.
Ist Calcium gefährlich?
BearbeitenNein, die meisten Calciumverbindungen sind nicht gefährlich. Vielmehr ist Calcium ein unentbehrlicher Nährstoff, welcher vom menschlichen Körper gebraucht wird, um starke Knochen und Zähne zu bekommen.
Calcium Metall entflammt leicht und brennt heiß, deshalb ist es feuergefährlich.
-
entzündbar
== Cobalt ==
 |
 |
Die Position von Cobalt im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus.
Bearbeiten
Kobalt ist ein silberblaues Metall.
Wie wurde es entdeckt?
BearbeitenIm Jahre 1735 stellte der schwedische Chemiker Georg Brandt Kobalt her.

Wo der Name herkommt
BearbeitenDer Name kommt von dem Wort Kobold. Die Bergleute glaubten, dass ein Kobold Silbererz so verzaubert hatten, dass man kein Silber daraus gewinnen konnte. Beim Erhitzen stinkt das Erz nach Knoblauch. (Dies sahen die abergläubischen Bergleute als einen Hinweis auf Zauberei.) Kobolde sind Hausgeister, die das Haus beschützen, aber auch Schabernack treiben.
- Wusstest du, dass...
- Vitamin B12 Kobalt enthält?
Wo wird es gefunden?
BearbeitenBei der Förderung von Kupfer und Nickel wird auch nebenbei Kobalt gewonnen.
Wofür wird es verwendet?
Bearbeiten
Zur Herstellung von festem Stahl für farbige Gläser und als Katalysator in der Chemieindustrie.
Ist es gefährlich?
BearbeitenEinige Cobaltverbindungen lösen Herzprobleme aus. (Cobalt-Kardiomyopathie)
-
Gesundheitsgefahr
== Chlor ==
 |
 |
Die Position von Chlor im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie fühlt es sich an und wie riecht es?
Bearbeiten

Elementares Chlor ist ein gelbgrünes, giftiges Gas mit einem stickigen Geruch. Wenn man es in Wasser auflöst, so kann es als chemisches Reinigungsmittel verwendet werden.
Wie wurde es entdeckt?
BearbeitenChlor wurde 1774 vom schwedischen Chemiker Carl Wilhelm Scheele entdeckt.
Woher hat es seinen Namen?
BearbeitenChlor leitet seinen Namen vom griechischen Wort chloros ab und bedeutet gelbgrün
Wo findet man Chlor?
BearbeitenChlor kommt auf der Erde relativ häufig vor. In der Natur kommt Chlor nicht elementar vor sondern nur gebunden in Verbindungen. Eine bekannte Verbindung ist zum Beispiel Kochsalz. Im Meerwasser finden sich sehr viele Chlorionen und auch im menschlichen Körper kommt Chlor vor.
- Wusstest du, dass...
- Brennstoffe in Chlor besser brennen als in Sauerstoff?
- Chlor ein Bestandteil der Salzsäure ist?
- der Magen täglich etwa 2 Liter Salzsäure produziert?
Wozu braucht man Chlor?
BearbeitenChlor braucht man vor allem für die Herstellung anderer Chemikalien (z.B. Salzsäure). Da Chlor eine desinfizierende Wirkung hat verwendet man es für die Wasseraufbereitung zum Beispiel in Schwimmbädern. Kochsalz ist eine Verbindung aus Chlor- und Natriumionen und wird als Gewürz in sehr vielen Speisen verwendet. Aus Kochsalz kann man Chlor und auch Salzsäure herstellen.
Ist Chlor gefährlich?
BearbeitenDas Gas ist Chlor sehr giftig und kann tödlich wirken. Chlor wurde im Ersten Weltkrieg als Kampfstoff eingesetzt, und hat viele Menschen getötet.
-
akut giftig
-
Gasflasche
-
wirkt entzündend
-
Umwelt
== Chrom ==
 |
 |
Die Position von Chrom im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Chrom aus, schmeckt, riecht und wie fühlt Chrom sich an??
BearbeitenChrom ist ein hartes, schmiedbares Metall und hat eine glänzende silberne Farbe.

Wie wurde Chrom entdeckt?
BearbeitenIm Jahre 1779 gewann Louis-Nicolas Vauqueli das Metall Chrom aus dem Mineral Krokoit.

Woher kommt der Name?
BearbeitenDer Name Chrom kommt von dem griechischen Wort chrṓma (χρώμα), was soviel wie Farbe bedeutet. (Auch die "Farbe" der Töne, also ihr Klang wurde so bezeichnet.)
- Wusstest du, dass...
- aus Chrom sehr viele Farbstoffe hergestellt werden können?
- ein menschlicher Körper Chrom enthält?
Wo findet man Chrom?
BearbeitenDas meiste Chromerz wird in Südafrika gefunden.
Wofür wird Chrom verwendet?
Bearbeiten
Chromverbindungen werden zur Herstellung von Farbstoffen verwendet. Häufig verwendet: Postgelb und Chromgrün. Fahrradlenker und Autostoßstangen werden mit dem silbrigen Chrom beschichtet. Sie sehen toll aus und verrosten nicht. Besonders wichtig ist Chrom für die Stahlherstellung. Chrom-Vanadium-Stahl rostet nicht und ist sehr fest. Auch zum Gerben von Leder werden Chromsalze eingesetzt.
Ist Chrom gefährlich?
BearbeitenChrom selber ist ungiftig, aber einige Chomverbindungen (z.B. die Chromate) sind giftig und krebserregend.
-
Umwelt
== Eisen ==
 |
 |
Die Position von Eisen im Periodensystem der Elemente.
|
Die Werte.
|
Einführung
Bearbeiten
Eisen entsteht in Riesensternen kurz bevor diese in eine Supernova explodieren.
Wir sieht es aus? Wie fühlt es sich an? Wie schmeckt es? und Wie riecht es?
Bearbeiten
Eisen glänzt metallisch und hat eine graue Färbung. Es ist fest und sehr schwer. Wenn es oxidiert (rostet) bekommt es eine unverwechselbare rot-braune Farbe. Eisen ist ein Feststoff und man benötigt sehr viel Hitze um es zu schmelzen, ungefähr 1500°C. Diese Temperatur ist heißer als der heißeste Teil einer Kerzenflamme. Um Eisen zu schmelzen brauchen Ingenieure und Wissenschaftler einen Schweißbrenner. Dieser Brenner hat eine sehr heiße Flamme mit der Eisen geschmolzen werden kann. Schweißbrenner werden auch verwendet wenn man zwei oder mehrere Eisenteile zusammenschmelzen (Schweißen) will. Wenn Eisen schmilzt leuchtet es rot.
Wie wurde es entdeckt?
Bearbeiten- Die Menschen kennen Meteor-Eisen seit der Antike. Vermutlich benutzt der Mensch Eisen seit über 5000 Jahren. Vor 4000 Jahren gelang es erstmals, Eisen aus Erzen herzustellen, ab 1200 v. Chr. wurde Eisen in größeren Mengen hergestellt. (Die Hethiter haben mit ihren Eisenwaffen die Nachbarländer besiegt und ein riesiges Reich geschaffen.)
- Wusstest du, dass...
- Eisen von den Sumerern Kupfer des Himmels („urudu-an-bar“) genannt wurde?
- dein Blut ohne Eisen, dass den Sauerstoff transportiert, weiß wie Milch wäre?
Woher stammt der Name Eisen?
BearbeitenDer Name "Eisen" stammt aus dem mittelhochdeutschen Wort "isen" was soviel wie kräftig bedeutet. Das chemische Symbol für Eisen "Fe" steht für "ferrum". Ferrum ist das lateinische Wort für Eisen.
Wo findet man Eisen?
BearbeitenEisen kommt in der Erdkruste in kleinen Mengen vor, der Erdkern besteht zu großen Teilen aus Eisen und auch Meteoriten aus dem Weltall enthalten Eisen. Das Eisen findet man fast nur gemischt mit anderen Gesteinen in Bergen oder tief in der Erde. Von dort muss das Eisen erst zusammen mit den den anderen Gesteinen abgebaut werden. Das macht man entweder durch Tagbau oder Untertagebau. Für den Tagbau werden sehr große Löcher gegraben um das Eisen abzubauen. Beim Untertagebau werden tiefe Stollen zum Beispiel in einen Berg hineingegraben. Das Gemisch aus Eisen und Gestein wird dann in einem Hochofen geschmolzen und getrennt.


Wozu braucht man Eisen?
BearbeitenFür die Herstellung von Autos, Lastwagen, Schiffe, Flugzeuge, Züge, Schienen, Brücken und allen möglichen Maschinen wird Eisen benötigt. Es gibt überhaupt nur wenige Maschinen die kein Eisen benötigen. Da Eisen sehr stabil ist, verwendet man Stahlträger um große Gebäude wie Wolkenkratzer zu bauen.
In Menschen und Tieren kommt Eisen als ein wichtiger Bestandteil eines Eiweißes (Hämoglobin) im Blut vor. Es ist verantwortlich für die rote Farbe des Blutes. Hämoglobin ist ein Protein, dass Sauerstoff in die Blutzellen bringt. In Pflanzen hilft Eisen bei der Produktion von Chlorophyll.
Ist Eisen gefährlich?
BearbeitenEisen ist relativ ungefährlich. Manche Eisenverbindungen sind in größeren Mengen für den Körper schädlich. Da der Körper aber nicht große Mengen über die Verdauung aufnimmt, geschieht eine Eisenvergiftung nur, wenn es zu Verletzungen im Darm kommt. Es besteht eher die Gefahr eines Eisenmangels. (Ungefährlich, kein GHS-Piktogramm.)
== Fluor ==
 |
 |
Die Position von Fluor im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Fluor aus? Wie riecht, schmeckt und fühlt Fluor sich an?
BearbeitenFluor ist im Allgemeinen ein blasses, schwach-gelbliches Gas und hat einen stechenden Gestank.
Wann wurde Fluor entdeckt?
Bearbeiten
Henri Moissan entdeckte und isolierte Fluor 1886. Viele andere Wissenschaftler scheiterten beim Versuch Fluor aus Fluorwasserstoff zu gewinnen. In manchen Fällen starben die Wissenschaftler beim Versuch, da sie versehentlich gefährliche Verbindungen schufen. Moissans erfolgreiche Methode beruhte auf Elektrolyse. Dabei legte er eine elektrische Spannung an, welche die Fluorionen zu Fluorgas umwandelte. Er gewann 1906 den Nobelpreis und starb ein Jahr darauf im Alter von 54 Jahren.
Woher kommt der Name?
BearbeitenDer Name Fluor kommt aus dem Lateinischen "fluor", was übersetzt "fließen" bedeutet. Flussspat wurde als Flussmittel in der Eisenverarbeitung genutzt, diese machten das geschmolzene Erz dünnflüssiger.
- Wusstest du, dass...
- Fluor das reaktivste Element ist?
- Glas in Fluor brennt?
- Fluor mitverantwortlich für die Stabilität der Knochen und Zähne ist?
- Flussspat so aussehen kann wie ein Smaragd oder ein Amethyst?
Wo findet man Fluor?
BearbeitenDa Fluor ein sehr reaktives Element ist kommt es fast nicht in elementarer Form vor. Man findet es immer an andere Elemente gebunden. Einige häufige Mineralien enthalte Fluor wie zum Beispiel in Fluorapatit und Kryolith. Länder in denen fluorhaltige Erze angebaut werden sind Mexiko, China, Südafrika, Spanien, Russland und auch Deutschland. In den USA gibt es seit 1995 keine Minen mehr aus denen Fluor gewonnen wird.
Wofür wird Fluor verwendet?
BearbeitenFluor wird selten in elementarer Form verwendet, weil es so reaktiv ist. Ein Verwendungszweck ist als Raketentreibstoff, dabei wird elementares Fluor anstatt Sauerstoff verwendet. Kraftstofftanks werden fluoriert, damit sie für Benzindämpfe weniger durchlässig werden. Fluorionen sind in Zahnpasta vorhanden und werden manchmal auch in Wasser gegeben, um die Zähne zu schützen.


Teflon, das als Beschichtung in Bratpfannen verwendet wird, ist ein Polymer, welches zu einem Großteil aus Fluor besteht.
Fluor wird in der Industrie in Form von Fluorwasserstoffsäure verwendet, da diese Säure Glas auflösen kann. Daher kann diese Säure auch nicht über lange Zeit in Glasbehältern aufbewahrt werden. Die Säure wird zum Ätzen und Reinigen von Glas und Metallen verwendet.
Ist Fluor gefährlich?
BearbeitenFluorgas ist extrem giftig. Es kann zu Verbrennungen auf der Haut führen. Auch viele Verbindungen sind sehr giftig. So ist Fluorwasserstoffsäure sehr gefährlich, da diese Säure wie andere Säure auch zu Verätzungen führen kann und leicht über die Haut aufgenommen wird. Einmal im Körper aufgenommen zerstört sie Gewebe und Organe. Einige Fluorionen, die in Zahnpasta und Wasser vorhanden sind, sind nicht schädlich, sondern schützen die Zähne vor Karies.
-
akut giftig
== Neutron ==
Ein geheimnisvolles Element, das in keinem Periodensystem aufgeführt ist?

Neutronen sind Bestandteile von Atomen, sie gibt es zusammen mit den Protonen in jedem fast Element. Eine Ausnahme bildet der Wasserstoff dessen Kern nur aus einem Proton besteht. Gibt es also auch Neutronen ohne Protonen als „Element“? Da Neutronen einander nur über die Schwerkraft anziehen und diese für Mengen von Neutronen wie sie auf der Erde vorkommen zu schwach ist um einen Klumpen Neutronen zu bilden, gibt es auf der Erde keine Klumpen aus Neutronen. Deshalb ist es auch nicht verwunderlich, dass Neutronen nicht im Periodensystem der Elemente aufgeführt werden. Manchmal wird darüber nachgedacht, wie sowas aussehen könnte. Dann wird von Neutronium gesprochen und man setzt es an im Periodensystem der Elemente an die Position ganz oben rechts oberhalb des Heliums.
Es gibt sogenannte Neutronensterne. Dort ist die Menge der Neutronen so groß dass sie durch die gegenseitige Schwerkraft zusammengehalten werden.
Wie sieht es aus? Wie riecht es, wie schmeckt es?
Bearbeiten
Einzelne Neutronen kann man weder sehen, riechen noch schmecken.
Wie wurde es entdeckt?
BearbeitenWalther Bothe und Herbert Becker produzierten 1930 dieses Elementarteilchen und wiesen es mit einem Messinstrument nach. Aber sie erkannten nicht, was sie entdeckt hatten. Erst zwei Jahre später fand James Chadwick heraus, um was für ein Teilchen es sich handelte und nannte es Neutron.
- Wusstest du, dass...
- ...die mittlere Lebensdauer von einzelnen freien Neutronen knapp 15 Minuten beträgt?
Woher kommt der Name?
BearbeitenDas Neutron wurde so genannt, weil es elektrisch neutral ist. Es hat das Formelzeichen n. Wenn über die Idee gesprochen wird, Neutronen könnten ein Element sein, nennt man es Neutronium oder auch Neutrium.
Wo wird es gefunden?
Bearbeiten
Man stellt einzelne Neutronen in Kernreaktoren her.
Astronomen haben Bilder von Sternen aufgenommen, in denen eine große Menge von einzelnen Neutronen vermutet werden.
Welche Einsatzmöglichkeiten gibt es?
BearbeitenNeutronen werden in der Strahlentherapie eingesetzt.
Neutronen spielen eine wichtige Rolle in Atomkraftwerken.
Ist es gefährlich?
Bearbeiten
Ja! Neutronenstrahlung ist eine gefährliche radioaktive Strahlung.
== Gold ==
 |
 |
Die Position von Gold im Periodensystem der Elemente.
|
Die Werte.
|
Gold ist ein sehr wertvolles, gelb glänzendes Metal. Wir schätzen Gold vor allem, weil es schön aussieht und glänzt. Außerdem kann man Gold mit einfachen Werkzeugen ohne Feuer oder Hitze verformen und so schöne oder praktische Gegenstände herstellen. Weil Gold so weich ist und man Goldklumpen oberirdisch finden kann, ist es vermutlich das erste Metall, das Menschen verarbeitet haben. Schon seit mehreren tausend Jahren wird Gold zu Goldmünzen und Schmuck verarbeitet. Bis heute gilt es als Zeichen für Wohlstand. Außerdem wird Gold heute zum Bau von Elektrogeräten und Computern benötigt.

Wo der Name herkommt
BearbeitenDas Wort Gold kann man auf gulþa, die germanische Bezeichnung für Gold zurückführen. Im altenglischen gibt es das Wort geolu, was gelb bedeutet. Das lateinische Wort für Gold ist aurum. Daher kommt auch das chemische Symbol für Gold: Au.
- Wusstest du, dass...
- Gold wahrscheinlich das erste Metall war, das Menschen benutzten?
- Gold so weich ist, dass die Menschen früher in Goldstücke oder Goldmünzen gebissen haben, wenn sie herausfinden wollten, ob das Gold echt ist?
Wofür wird Gold verwendet?
BearbeitenDer größte Teil des gewonnenen Goldes wird für die Herstellung von Schmuck verwendet. Es wird zu Ringen, Ketten, Armbändern, Ohrringen und anderem Schmuck verarbeitet. Gold wird außerdem als Währung verwendet und zur Herstellung von Münzen und Goldmünzen. Es wird auch in der Elektronikindustrie verwendet, da Gold sehr leicht zu verarbeiten und sehr widerstandsfähig ist. Hauptsächlich wird es für Kontakte, Flächen und Drähte in Elektrogeräten (z.B. Computer, Fernseher) verwendet. Eine weitere Verwendung von Gold ist das Blattgold. Gold lässt sich durch Hämmern zu einer hauchdünnen Folie verarbeiten. Mit einem Gramm Gold lässt sich ein halber Quadratmeter Blattgold herstellen. Es ist dann so dünn, das 10.000 Lagen Blattgold nur einen Millimeter dick sind. Mit Blattgold werden Bilderrahmen, Möbel und Statuen vergoldet. In früheren Kulturen wurden sogar Teile von Gebäuden, zum Beispiel Säule oder Turmspitzen vergoldet, wenn die Menschen zeigen wollten wie reich sie sind, oder wie sehr sie ihre Götter verehren.

Wo man Gold findet
BearbeitenGold ist sehr selten und schwer zu finden. Ohne danach zu graben, findet man kleine Mengen von Gold im Sand von Flüssen oder zwischen Kieselsteinen in Gebirgsbächen. Goldflocken und kleine Goldklumpen (Nuggets), die im Gestein eingeschlossen sind, kommen zum Vorschein, wenn Wasser das Gestein aufbricht. Das Gold wird dann vom Wasser talwärts getragen, und setzt sich zusammen mit Sand und Kies dort wieder ab, wo der Fluss langsamer fließt. Goldsucher können dann mit einer Art Pfanne das Gold herausfiltern. Dazu schwenken sie die Pfannensiebe mit Sand und Kieselsteinen vom Flussgrund im Wasser. Die schweren Goldstücke setzen sich unten ab. Weil die ergiebigsten Stellen inzwischen ausgebeutet sind, gibt es heute nur noch wenige Goldsucher.
Größere Mengen Gold findet man unter der Erde in goldhaltigen Gesteinsschichten. Deshalb gräbt man heute Minen tief in die Erde. Man spricht hier vom Gold schürfen. Eine Goldmine in Südafrika ist mit einer Tiefe von 3.600 Metern das tiefste Bergwerk der Welt. Zum Vergleich: Die Zugspitze ist mit 2.962 m der höchste Berg Deutschlands.

Ist Gold gefährlich?
BearbeitenReines Gold ist ungefährlich. Gold reagiert nur mit wenigen Substanzen. Wenn Gold sehr rein ist, kann man es zu dünnen Blättern auswalzen und dann zum Dekorieren von Lebensmitteln verwenden und sogar mitessen („essbares Gold“). Mit Gold werden auch Löcher in Zähnen gefüllt, oder man kann die Zähne mit einer Goldkrone schützen. Und obwohl sich das Gold dann den ganzen Tag im Mund befindet, ist es ungefährlich. Zahngold ist übrigens nicht rein, sondern enthält zusätzlich Platin, um es härter zu machen. (Ungefährlich, kein GHS-Piktogramm.)
== Helium ==
 |
 |
Die Position von Helium im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Helium aus? Wie riecht und schmeckt es? Und wie fühlt es sich an?
Bearbeiten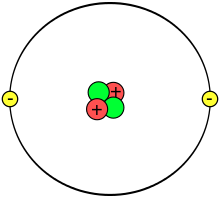
Helium ist ein farbloses, geruchloses Gas. Es ist das klarste Element und sogar im flüssigen Zustand, der nur durch extreme Kälte erreicht werden kann, nahezu durchsichtig.
Wie wurde es entdeckt?
Bearbeiten
Helium wurde 1868 in der Sonne durch Sir Norman Lockyer entdeckt. Er nutzte dafür das Sonnenspektrum. So ein Spektrum erzeugt man, indem man das Licht der Sonne mit Hilfe eines Prismas in viele unterschiedliche Farben aufteilt. Jedes Element erzeugt dabei ein unterschiedliches Muster. Lockyer bemerkte, dass eine Linie in diesem Spektrum zu keinem bekannten Element passte und zu einem neuen Element gehören musste, das bisher noch nicht auf der Erde gefunden worden war.
Erst mehr als 27 Jahre später, im Jahre 1895, entdeckte Sir William Ramsay in dem Uran-Mineral Cleverit Helium auf der Erde. Dieselbe Entdeckung machten fast gleichzeitig der britische Physiker William Crookes und die schwedischen Chemiker Per Teodor Cleve und Nicolas Langlet.
Woher sein Name kommt...
BearbeitenDas Helium erhielt seinen Namen von dem griechischen Wort für Sonne Helios, weil er zuerst auf der Sonne und erst später auf der Erde entdeckt wurde.
- Wusstest du, dass...
- Helium das zweithäufigste Element im Universum ist?
- Helium ein Edelgas ist und deshalb nicht so leicht mit anderen Stoffen reagiert?
- Helium genutzt wurde, um die Struktur eines Atoms zu erforschen?
Wo findet man es?
BearbeitenHelium findet man sehr häufig im Universum, aber nicht besonders oft auf der Erde. Heutzutage kommt das meiste Helium aus Kansas und Texas in den Vereinigten Staaten von Amerika, wo es aus Erdgas gewonnen wird.
Wozu brauchen wir Helium?
Bearbeiten
- Helium wird als Traggas von Luftschiffen und Gasballons verwendet, da Helium fast so leicht wie Wasserstoff, aber im Gegensatz zu Wasserstoff nicht brennbar ist.
Vielleicht hast du auch schon einmal gesehen, dass Menschen, die Helium einatmen, eine hohe Stimme bekommen. Das kommt daher, dass Helium leichter als Luft ist und so schneller aus der Lunge entweicht. Wenn alles Helium ausgeatmet wurde, wird die Stimme wieder normal.
- Helium wird zusammen mit Sauerstoff und manchmal auch Stickstoff als Atemgas für Taucher verwendet, die sehr tief gehen und deshalb auch höheren Druck brauchen.
- Flüssiges Helium, welches die kälteste bekannte Flüssigkeit ist, wird als Kühlmittel verwendet. So erzeugt es zum Beispiel bei der Kernspintomographie, auch Magnetresonanztomographie (MRT) genannt, durch die extreme Kälte starke Magnetfelder.
Ist es gefährlich?
BearbeitenObwohl Helium nicht giftig ist, kann man ersticken, wenn man zuviel davon einatmet. Es fehlt dem Körper der zum Leben notwendige Sauerstoff. (Gasflaschen zum Füllen von Luftballons enthalten meist eine Mischung von Luft und Helium.)
-
Gasflasche
.
== Iod ==
 |
 |
Die Position von Iod im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie riecht es, wie schmeckt es?
BearbeitenIod ist ein violettgrauer, metallisch glänzender Feststoff. Schon bei Zimmertemperatur und besonders beim Erhitzen sublimieren Iodkristalle zu einem lila-pinken Gas, das einen eigenartigen Geruch hat. Iod kann man schmelzen, wenn man es rasch auf ca. 120°C erhitzt. Es entsteht eine braune Flüssigkeit aus der violetter Dampf aufsteigt.

Wie wurde Iod entdeckt?
BearbeitenIod wurde von Barnard Courtois im Jahre 1811 zufällig entdeckt.
Woher kommt der Name?
BearbeitenIod hat seinen Namen von dem griechischen Wort „ioeides“ (ιο-ειδής), was violett bedeutet. Falls du schon mal was von Jod gehört hast: Das ist der weitaus gebräuchlichere Begriff für dieses Element.
- Wusstest du, dass...
- Iod beim Erwärmen nicht flüssig wird sondern zu Iod-Gas sublimiert?
- Iod deinen Stoffwechsel reguliert?
Wo wird es gefunden?
BearbeitenIod ist im Meerwasser als Iodsalz gelöst. Algen und Seetang nehmen das Salz auf und speichern es. Die Pflanzen werden am Strand gesammelt und verbrannt. Das Iodsalz löst sich im zugegebenen Wasser auf. Es somit einfach Jodid (I-) zu gewinnen.
Welche Einsatzmöglichkeiten gibt es?
Bearbeiten
Iod ist für viele Organismen lebenswichtig. So enthält beispielsweise das Schilddrüsenhormone Iod, das in der Schilddrüse im Hals produziert wird. Wenn die Nahrung zu wenig Iodsalz enthält, wächst die Schilddrüse. Es bildet sich der sogenannte "Kropf".
Man kann Iod in Alkohol auflösen. Diese Jodtinktur tötet Bakterien, brennt aber stark in den Wunden, wenn sie desinfiziert werden. Weiterhin kann sie eine Allergie auslösen.
Iod färbt Stärke blau. Deshalb wird es als Stärkenachweis verwendet. - Und Stärke wird als Iodnachweis verwendet.
Ist es gefährlich?
BearbeitenElementares Iod ist gefährlich und giftig und sollte nicht mit den Händen berührt werden.
-
Umwelt
-
Achtung
== Kalium ==
 |
 |
Die Position von Kalium im Periodensystem der Elemente.
|
Die Werte.
|
Was ist Kalium?
Bearbeiten

Kalium ist ein silbrig weißes Metall. Es ist leicht und so weich, dass man es wie Lithium und Natrium mit einem Messer schneiden kann.
Wie wurde Kalium entdeckt?
BearbeitenKalium wurde 1807 von Humphrey Davy aus Kaliumhydroxid (KOH) gewonnen.
Woher kommt der Name?
BearbeitenDer Name "Kalium" kommt vom arabischen Wort für "Pflanzenasche".
Wo wird es gefunden?
BearbeitenKalium ist das siebthäufigste Element auf der Erde und macht fast 3% der Erdkruste aus. Kalium ist ein sehr reaktives Metall und kommt nicht als Element in der Natur vor. Stattdessen wird Kalium in der Regel in Mineralien wie Sylvinit, Carnallit, Langbeinit und Polyhalit gefunden. Diese Mineralien haben sich dort gebildet, wo ein See oder eine Meeresbucht ausgetrocknet ist. Kalisalze werden in Deutschland, in New Mexico, Kalifornien und Utah in den Vereinigten Staaten abgebaut.
- Wusstest du, dass...
- Kalium anfängt zu brennen, wenn es Wasser berührt?
- Kalium im menschlichen Körper unter anderem den Wasserhaushalt der Zellen regelt?
Was sind seine Einsatzmöglichkeiten?
BearbeitenPflanzen brauchen Kalium um zu wachsen. Im Boden findet man Kalium in der Regel in Form von Kaliumchlorid (KCl) oder Kaliumnitrat (KNO3). Darüber hinaus ist das Salz Kaliumchlorid wichtig bei der Herstellung von anderen Chemikalien. Kaliumnitrat, auch bekannt als Salpeter, wird verwendet um die Köpfe von Streichhölzern oder Schießpulvers herzustellen. Kaliumhydroxid (KOH) ist ein wichtiger Bestandteil von Seifen, Waschmitteln und Abflussreinigern. Kaliumcarbonat (KHCO3) oder Pottasche wurde früher aus der Asche von Bäumen gewonnen. Heute entsteht es als ein Nebenprodukt bei der Ammoniakgewinnung. Pottasche benötigt man bei der Herstellung von Glas.
Ist es gefährlich?
BearbeitenKaliumsalze sind lebenswichtig, aber größere Mengen sind gesundheitsschädlich. Salze bilden im Wasser geladene Teilchen, die Ionen - das sind elektrisch geladene Atome oder Moleküle. Nerven produzieren und leiten Elektrizität. Um den elektrischen Strom zu erzeugen, werden Kaliumionen (Kaliumsalz) und Natriumionen (Kochsalz) benötigt.
Reines Kalium, Kaliumhydroxid und seine Lösungen sollten nicht berührt werden, denn sie sind stark ätzend!!!!!!!.
Falsch gelagertes Kalium bildet eine explosive Kruste. Dies hat schon zu vielen Unfällen geführt.
-
entzündbar
-
ätzend
== Kohlenstoff ==
 |
 |
Die Position von Kohlenstoff im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus und wie fühlt es sich an?
Bearbeiten
Das Aussehen von Kohlenstoff hängt von seiner molekularen Struktur ab. Kohlenstoff gibt es in vielen Formen (Graphit, Holzkohle, Diamant, ...) die man „allotrope Modifikationen“ nennt.
Eine der bekanntesten Kohlenstoffmodifikationen ist Diamant. Er ist sehr rein und glänzt stark. Diamanten sind sehr wertvoll und erreichen auf einer Härteskala von 1-10 die Nummer 10 (Diamant ist das härteste Element in der Natur). Weniger wertvolle Diamanten können auch mit anderen Kohlenstoffmodifikationen produziert werden. Außerdem ist Diamant einer der seltenen Stoffe, die sehr gut Hitze leiten, Strom aber überhaupt nicht. Diamanten können brennen.
Ein weiterer, sehr bekannter Kohlenstofftyp ist Graphit, der in Bleistiftminen zu finden ist. Graphit ist grau und sehr weich, er bekommt auf der Härteskala die Nummer 1.
Wie wurde Kohlenstoff entdeckt und woher hat es seinen Namen?
BearbeitenDie Menschen kannten Kohlenstoff schon vor langer Zeit und verwendeten ihn damals in Form von Holzkohle. Der deutsche Name Kohlenstoff kommt vom altgermanischen Wort kolo für Kohle. Im Englischen heißt der Kohlenstoff „carbon“, dies stammt vom lateinischen Namen carbo für Holzkohle. Daher kommt das chemische Symbol C.
- Wusstest du, dass...
- Kohlenstoff bei höheren Temperaturen länger fest bleibt als andere Stoffe?
- Kohlenstoff das einzige Element ist, welches sich mit sich selbst zu großen Ketten und Molekülen zusammenschließen kann?
- die meisten bekannten Moleküle Kohlenstoff enthalten?
- Kohlenstoff eines der vier Hauptelemente der meisten oder sogar aller Lebewesen ist?
- Kohlenstoff bei hohen Temperaturen gasförmig wird, ohne dazwischen einmal flüssig zu werden?
- Kohlenstoff der wichtigste Bestandteil von Eiweißen, Fetten und Kohlenhydraten (z.B. Zucker und Mehl) ist?
Wo kommt Kohlenstoff vor?
BearbeitenKohlenstoff findet man an vielen Orten. Diamant und Graphit, welche alle aus Kohlenstoff bestehen, findest du tief unter der Erde. Kohlenstoff ist außerdem in allen Lebewesen und organischen Verbindungen enthalten, wie Fett Zucker oder Öl. Auch in der Atmosphäre findest du Kohlenstoff als Teil von Kohlenstoffdioxid und anderen Verbindungen. Manche Wissenschaftler vermuten, dass ohne Kohlenstoff kein Leben auf der Erde möglich wäre. Andere glauben, dass es auch Lebewesen geben könnte, die auf dem Basiselement Silizium (Si) aufgebaut sind.

Wofür wird Kohlenstoff gebraucht?
BearbeitenDiamanten werden häufig zur Dekoration genutzt oder in Schmuck verarbeitet. Da Diamanten so hart sind, werden sie manchmal auch als Schneidewerkzeuge benutzt. Diese sind allerdings sehr teuer.
Graphit ist sehr weich. Deswegen bestehen die meisten Bleistiftminen aus Graphit, auch wenn sie Bleistifte heißen.
Wird Kohlenstoff zusammen mit Eisen in einem Ofen erhitzt, so entsteht Stahl.
Verbindet sich der Kohlenstoff mit Wasserstoff, so entstehen Kohlenwasserstoffmoleküle. Sie sind sehr wichtig, da sie Energie speichern können. Einer der bekanntesten Kohlenwasserstoffe ist das Erdöl. Aus Erdöl werden unter anderem hergestellt:
- Benzin und Diesel für Fahrzeuge
- Heizöl, um deine Wohnung zu heizen
- Schmiermittel, zum Beispiel um deine Fahrradkette zu ölen
- viele Plaste
Auch im Lebensmittelbereich kommt Öl zum Einsatz, allerdings Speiseöl, das nicht aus Erdöl hergestellt wird, sondern aus fetthaltigen Früchten, wie z. B. Oliven, oder aus Nüssen und Kernen gepresst wird.
Ist Kohlenstoff gefährlich?
BearbeitenKohlenstoff ist im Prinzip ungefährlich. Eingeatmeter Ruß oder Rauch allerdings ist schädlich für die Lungen und enthält viel Kohlenstoff. Kohlenstoff ist auch ein Teil von Kohlenstoffdioxid, welches mit der globalen Klimaerwärmung verbunden wird. Wenn Kohlenstoff unter Sauerstoffmangel unvollständig verbrennt, entsteht das sehr giftige Kohlenstoffmonoxid, also atme lieber nicht den Rauch ein, der aus dem Auspuff eures Autos kommt. Auch wegen des krebserregenden Benzols, doch dazu später mehr. (Ungefährlich, kein GHS-Piktogramm.)
== Kupfer ==
 |
 |
Die Position von Kupfer im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie schmeckt Kupfer und wie fühlt es sich an?
Bearbeiten
Kupfer ist ein rot-oranges Metall und gehört (genauso wie Gold) zu den einzigen beiden Metallen die nicht silbern oder grau sind.
Wie wurde Kupfer entdeckt?
BearbeitenBereits vor 10 000 Jahre schon fanden Menschen kleine Vorkommen von reinem Kupfer im Erdboden. Dieses Kupfer wurde dann zu Waffen, Werkzeugen und Schmuck verarbeitet. Im Nordirak wurde Kupferschmuck gefunden der schon 8700 v. Chr. entstanden ist.
Woher kommt der Name?
BearbeitenDer Name Kupfer kommt aus dem Lateinischen Cuprum bedeutet von der Insel Zypern. In der antiken römischen Welt, in der Latein die meist gesprochene Sprache war, wurde das meiste Kupfer in Zypern abgebaut.
- Wusstest du, dass...
- Kupfer das Symbol für die römische Göttin Venus war? Vor dieser Göttin hatten die Einwohner der Insel Zypern Angst .
- die Freiheitsstatue aus 81,3 Tonnen Kupfer besteht?
- in Wasser gelöstes Kupfersalz das Wasser blau färbt?
Wo findet man Kupfer?
BearbeitenKupfer kann im Erdboden in Form von Kupfererzen gefunden werden. Kupfererze werden hauptsächlich in Chile, den USA, Indonesien, Australien, Peru, Russland, Kanada, China, Polen, Kasachstan, Sambia, Zaire und Mexiko gewonnen. Häufige Kupfererze sind Cuprit (CuO2), Tenorit (CuO), Malachit (CuO3*Cu(OH)2), Chalkosin (Cu2S), Covellin (CuS) und Bornit (Cu6FeS4).
Wofür wird Kupfer verwendet?
Bearbeiten

Da Kupfer ein guter elektrischer Leiter ist wird es für Drähte in Elektroleitungen verwendet. Solche Kupferdrähte leiten den Strom zu Wohnhäuser, Schulen und Geschäften. Weil dafür viel Kupfer gebraucht wird, aber nicht so viel gewonnen werden kann, ist es relativ teuer.
Aus Kupfer kann man sehr harte goldfarbene Legierungen herstellen. Eine „Legierung“ ist, wenn man verschiedene Metalle schmilzt, vermischt und wieder fest erstarren lässt. Aus solchen goldfarbenen Legierungen werden Münzen hergestellt, aber auch Türschlösser, Rohre, Türgriffe, Töpfe, Bronze und Schmuck.
Ist es gefährlich?
BearbeitenIn kleinen Mengen ist Kupfer ein lebensnotwendiges Spurenelement. Dennoch ist Kupfer in größeren Mengen giftig.
-
entzündbar
-
Umwelt
== Lithium ==
 |
 |
Die Position von Lithium im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie schmeckt Lithium und wie fühlt es sich an?
Bearbeiten
Lithium ist ein silbrig-gräuliches Metall und ist das leichteste Metall.
Wie wurde Lithium entdeckt?
BearbeitenLithium wurde 1817 in Schweden von Johan August Arfwedson entdeckt, als dieser Mineralien untersuchte.
- Wusstest du, dass...
- Lithium mit roter Flamme brennt?
- aus Lithium ein Medikament gegen psychische Krankheiten gemacht wird?
Woher kommt der Name?
BearbeitenDer Name Lithium kommt aus dem griechischen und bedeutet "Stein"
Wo findet man Lithium?
Bearbeiten
Da Lithium sehr reaktiv ist, kommt es in der Natur nicht in reiner Form vor. Lithium reagiert mit der Luftfeuchtigkeit und bildet dabei auf seiner Oberfläche eine matte-graue Schicht. Lithium kommt in kleinen Mengen in der Erdkruste in Form von Mineralien oder als Salz in Salzseen vor. Da Mineralien und die Salzseen aber nur geringe Mengen an Lithium besitzen ist, die Gewinnung von Lithium aufwendig. Abgebaut wird Lithium in den Ländern Australien, Kanada, Russland, USA, China, Chile und Argentinien. In einem Salzsee von Bolivien werden sehr große Mengen an Lithium vermutet.
Wofür wird Lithium verwendet?
BearbeitenLithium wird in Batterien, in anderen Metallen als Legierungsbestandteil, für die Glasherstellung und für Keramiken und in der Luft- und Raumfahrttechnik verwendet.
Ist es gefährlich?
BearbeitenLithium ist nicht giftig reagiert jedoch sehr stark mit Wasser. Da es mit der Hautfeuchtigkeit reagiert, führen Berührungen zu Verätzungen.
-
ätzend
-
entzündbar
.
== Magnesium ==
 |
 |
Die Position von Magnesium im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus, fühlt es sich an und riecht es?
Bearbeiten
Magnesium als Metall ist silber-weiß und leichtgewichtig. Hier ist es als kleiner Stab abgebildet, es gibt es aber auch in Pulverform.
Wie wurde es entdeckt?
BearbeitenSir Humphry Davy konnte reines, metallisches Magnesium 1808 das erste Mal elektrolytisch isolieren. Bevor Davy es isolieren konnte, wurde es von Black bereits 1755 als Element entdeckt.
Woher hat es seinen Namen?
BearbeitenMagnesium hat seinen Namen von einer griechischen Region in Thessalien die "Magnesia" heißt.
- Wusstest du, dass...
- Magnesiumflammen 3000°C heiß werden können?
- 1,3 kg Magnesium in jedem Kubikkilometer Meerwasser gefunden werden kann?
- Magnesium in Leuchtraketen und Feuerwerken verwendet wird, um ein strahlend weißes Licht zu erzeugen?
- Magnesium ein wichtiges Element beim Blattgrün der Pflanzen ist?
- Magnesium wichtig für die Funktion deiner Muskeln und Nerven ist?
Wo ist es zu finden?
BearbeitenMagnesium ist als reines Metall nicht in der Natur zu finden, aber es tritt sehr häufig als ein Ion in verschiedenen Verbindungen auf. Es ist das acht-häufigste Element.
Magnesium ist sehr verbreitet auf der Erde und im Meerwasser.
Magnesium kann in grünem Gemüse gefunden werden, vor allem in sehr dunkelgrünem Gemüse.
Was ist seine Nutzen?
BearbeitenMagnesium ist für alle lebenden Zellen notwendig. Es hilft unserem Körper Moleküle wie die DNS zu produzieren. Auch Pflanzen nutzen Magnesium als Bestandteil des Chlorophylls für die Photosynthese. Bei Magnesiummangel treten Krämpfe auf. (Achte beim Kauf von Mineralwasser auf den Magnesiumgehalt. Nach dem Sport ist ein magnesiumreiches Mineralwasser sinnvoll, es schmeckt aber leicht bitter.) Magnesiumsalze schmecken bitter und größere Mengen davon sind ungesund.
Magnesium brennt in einem sehr hellen Weiß. Früher wurde Magnesium als Lichtquelle verwendet und man hat damit den Blitz für Kameras gemacht. Heute wird es meistens für Feuerwerke verwendet. Es wird auch verwendet, um Brandbomben zu bauen.
Da Magnesium um ein Drittel leichter ist als Aluminium, wird es mit anderen Materialien kombiniert und für den Bau von Raketen und Flugzeugen verwendet. Es wird auch in der Automobilindustrie eingesetzt.
Magnesiumoxid (MgO) - auch Magnesia genannt, wird in manchen Tabletten zur Minderung der Magensäure verwendet. Magnesium wird auch verwendet um Bittersalz herzustellen, mit dem kleinere Schürfwunden behandelt werden.

Ist es gefährlich?
BearbeitenSehr feines Magnesiumpulver kann sich selbst entzünden. Magnesiumstücke sind brennbar und das helle Licht, das dabei entsteht, kann die Augen schädigen. Magnesiumbrände dürfen nicht mit Wasser gelöscht werden, da dabei ein explosives Gas entsteht. Niemals ins Feuer oder in Säuren werfen, dadurch können leichtentzündliche Wasserstoffgase entstehen.
Magnesium darf nicht gegessen werden. Man darf es noch nicht einmal in den Mund nehmen. Beim Verschlucken sofort einen Notarzt verständigen. (Von Kindern fernhalten.)
-
entzündbar
== Mangan ==
 |
 |
Die Position von Mangan im Periodensystem der Elemente.
|
Die Werte.
|

Wie sieht es aus? Wie riecht, schmeckt Mangan und wie fühlt es sich an?
BearbeitenMangan ist ein leichtes, gräuliches Metall, welches ähnlich wie Eisen aussieht. Es ist ein hartes sprödes Metall.
Wie wurde Mangan entdeckt?
BearbeitenEs wurde 1774 von Johan Gahn entdeckt indem er es aus Braunstein extrahierte.
- Wusstest du, dass...
- Manganoxid in alten Höhlenmalereien in den Höhlen von Ekain und Lascaux in Frankreich verwendet wurde?
- Kaliumpermanganat violett färbt und später braune Flecken hinterlässt, die schwer zu entfernen sind?
Woher kommt der Name?
BearbeitenDer Name Mangan kommt aus dem griechischen und bedeutet "ich entfärbe wirklich". In der Antike wurde Mangan in der Glasherstellung verwendet um damit Glas entweder braun zu färben oder durchsichtig zu machen.
Wo findet man Mangan?
Bearbeiten
Mangan kommt in der Erdkruste häufig vor, jedoch nicht elementar sondern nur in Verbindungen. Diese sind Mangansilikate, Mangancarbonate und Manganoxide. Häufige Minerale sind Braunsteine, Manganit, Hausmannit, Braunit, Rhodochrosit und Rhodonit. Etwa 75 % der bekannten Ressourcen an Mangan kommen in der Kalahari (Wüste) Südafrikas vor. Auch in der Ukraine, Brasilien, Australien, Indien, Gabun und China finden sich größere Manganvorkommen.
Wofür wird Mangan verwendet?
BearbeitenMangan wird in Stahl, Batterien und Keramik verwendet.
Ist es gefährlich?
BearbeitenMangan ist nicht giftig, jedoch ist es in pulverisierter Form leicht entzündlich. Als sehr feiner Staub kann es auch giftig wirken und in der Lunge schädlich wirken.
-
entzündbar
== Natrium ==
 |
 |
Die Position von Natrium im Periodensystem der Elemente.
|
Die Werte.
|

Wie sieht Natrium aus, riecht und schmeckt es?
BearbeitenReines Natrium ist ein weiches silbriges Metall. Natrium ist ein sehr reaktives Metall, das heftig mit Wasser reagiert. Natrium wird daher zum Schutz vor Wasser und Luft in Paraffinöl oder Petroleum gelagert. Es ist ein so weiches Metall, dass man es mit einem Messer schneiden kann. Man kann es in reiner Form nicht schmecken, da es zu schnell mit dem Wasser der Spucke reagiert und dadurch gefährlich ist. Es wird heiß und dabei entsteht eine ätzende Flüssigkeit und Wasserstoff. Wenn es es mit Chlor zusammen vorkommt, schmeckt es salzig. Je mehr dieser Verbindung enthalten ist, desto salziger schmeckt es (z.B. Wasser oder Essen).
Wie wurde Natrium entdeckt?
BearbeitenNatrium wurde 1807 von Humphrey Davy entdeckt. Er isolierte es durch Schmelzflusselektrolyse aus Natriumhydroxid (NaOH).
Woher kommt der Name?
BearbeitenDer deutsche Name "Natrium" kommt aus dem arabischen Wort "natrun" welches ursprünglich aus dem ägyptischen kommt. Der englische Name "Sodium" wurde von Humphrey Davy von dem englischen Wort "Soda" eingeführt.
- Wusstest du, dass...
- die Ägypter mit Natron ihre Mumien konserviert haben.
- Natrium das sechsthäufigste Element der Erde ist?
- Natrium das häufigste Alkalimetall ist?
- Natriumionen einen salzigen Geschmack haben?
- Natrium in Form von Kochsalz den Wasserhaushalt deiner Zellen regelt?
Wo findet man Natrium?
BearbeitenDa Natrium ein sehr reaktives Element ist, findet man es in der Natur nie in reiner Form, sondern nur in Verbindungen. Die häufigste Verbindung von Natrium ist Natriumchlorid (NaCl), also Kochsalz. Man findet es daher in Meerwasser und in Gebirgen als Steinsalz. Natrium ist auch relativ häufig in Sternen.
Wofür wird Natrium verwendet?
Bearbeiten
Wir verwenden Natrium jeden Tag, da es als Salz (NaCl) in unserem Essen als Gewürz vorkommt. Ferner benutzen wir es als Backpulver oder Soda in der Verbindung (NaHCO3). Natrium wird außerdem in in den meisten Seifen und Reinigungsmitteln verwendet.
Natrium wird im Körper für Blut-, Gehirn-, Zell- und Herzaktivitäten benötigt. Es ist so wichtig, dass Menschen und Tieren an das salzige Natriumion angepasst sind.
Ist Natrium gefährlich?
BearbeitenNatrium ist ein sehr reaktives Metall, wenn es mit Wasser in Berührung kommt entsteht Wasserstoffgas welches mit Luft explodieren kann, die so genannte Knallgasexplosion. Die Lauge Natriumhydroxid (NaOH) ist stark ätzend und darf nicht berührt werden.
-
ätzend
-
entzündbar
.
== Neon ==
 |
 |
Die Position von Neon im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus, fühlt es sich an, riecht und schmeckt es?
BearbeitenBei Raumtemperatur ist Neon ein farb- und geruchloses Gas.
Wie wurde es entdeckt?
Bearbeiten1898 wurde es vom schottischen Chemiker William Ramsay und dem englischen Chemiker Morris Travers entdeckt.

Woher hat es seinen Namen?
BearbeitenNeon hat seinen Namen vom griechischen Wort neos was "neu" bedeutet.
- Wusstest du, dass...
- Neon seit vielen Jahren als Lichtquelle verwendet wird?
- Neon im Plasma-Zustand in einem rötlich-orangen Licht strahlt?
Wo kann man es finden?
BearbeitenNeon ist überall im Universum zu finden, kommt auf der Erde aber nur selten vor. Nach Stickstoff (78%), Sauerstoff (21%) und Argon (0,9%) ist Neon (0,002%) das vierthäufigste Element in der Atmosphäre.
Wie wird es verwendet?
BearbeitenNeon wird für Leuchten und einige Laser verwendet. Im unteren Beispiel ist Neon in seiner charakteristischen rötlich-orangen Farbe zu sehen.

.
Ist es gefährlich?
BearbeitenNein, Neon ist ein Edelgas. Es ist geruchlos und hat keinen Effekt auf den Menschen. Außer Neongas verdrängt den Sauerstoff, denn alle Menschen benötigen Sauerstoff zum Atmen. Wenn eine Neonflasche undicht wird, könnte das ausströmende Neongas den Sauerstoff verdrängen und dann bestünde Erstickungsgefahr.
Neonleuchten können heiß werden, bei der Berührung kann man sich verbrennen. Wenn Neonröhren zerbrechen, kann es bei empfindlichen Menschen zu einer lebensbedrohlichen Atemwegsentzündung kommen. Dieses hat aber nichts mit dem in der Lampe enthaltenen Neongas zu tun, sondern mit der Quecksilberbeschichtung, die ebenfalls in einer Neonlampe enthalten ist.
-
Gasflasche
.
== Nickel ==
 |
 |
Die Position von Nickel im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Nickel aus und fühlt es sich an. Wie schmeckt und riecht es?
Bearbeiten
Nickel ist ein silberweißes Metall.
Wie wurde es entdeckt?
BearbeitenNickel wurde im Jahr 1751 in Stockholm, Schweden vom schwedischen Wissenschaftler Axel Fredric Cronstedt entdeckt.
Wo der Name herkommt
BearbeitenDieses Element wurde nach einer deutschen Legende "Nickel" genannt. „Niggel“ nannte man eine Art Berggeister. Bergleute glaubten manchmal Kupfererz gefunden zu haben, aber sie konnten daraus kein Kupfer gewinnen. Sie beschuldigten die Berggeister, die Nickeln, das Erz verhext zu haben. Auch das Element „Kobalt“ wurde nach solchen Kobolden benannt.
- Wusstest du, dass...
- einige Haken eine Schicht aus Nickel haben, damit sie nicht so schnell rosten?
Wo wird es gefunden?
BearbeitenNickel kommt häufig in der Erdkruste vor.
Wofür wird Nickel verwendet?
Bearbeiten
Nickel wird in vielen Münzen verwendet.
Ist es gefährlich?
BearbeitenNickel kann bei Hautkontakt allergische Reaktionen auslösen. Deshalb gab es manchmal auch Probleme mit Ohrringen. Aus diesem Grund werden heute viele Ohrringe nickelfrei hergestellt.
-
Gesundheitsgefahr
-
Achtung
== Phosphor ==
 |
 |
Die Position von Phosphor im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Phosphor aus und fühlt es sich an. Wie schmeckt und riecht er?
Bearbeiten
Elementarem Phosphor kommt in vier Formen: Weißer Phosphor, roter Phosphor, lila Phosphor und schwarzer Phosphor. Weißer Phosphor ist sehr reaktiv und entzündet sich an der Luft von alleine und brennt. Deshalb wird er üblicherweise unter Wasser gelagert. Die anderen Formen sind nicht so reaktiv. Phosphor kann nach Knoblauch riechen.
Wie wurde Phosphor entdeckt?
BearbeitenPhosphor wurde vom Alchemisten Hennig Brand im Jahre 1669 entdeckt. Nach vielen Experimente entstand der Phosphor beim Verarbeiten, Eindampfen und Destillation von Urin. Brand erhielt eine weißliche, im Dunkeln selbstleuchtende Substanz. Hennig Brand (* um 1630; † 1692) war ein deutscher Apotheker und Alchemist.

Woher kommt der Name?
BearbeitenDas griechische Wort „phosphorus“ bedeutet „Lichtträger“.
- Wusstest du, dass...
- Phosphor im Dunklen leuchtet, wenn es mit radioaktiven Elementen kombiniert wird?
- Phosphor deine Gene zusammen hält?
- mitverantwortlich für den Energietransport in der Zelle ist?
Wo wird es gefunden?
BearbeitenPhosphor kommt nicht als Element, sondern nur as Verbindung in der Natur vor. Die größten Vorkommen an Phosphat-Mineralien findet man in der Wüste in Afrika. Eine Verbindung des Phosphors, Calciumphosphat (Ca3(PO4)2), ist ein wichtiger Bestandteil der Knochen. Eine weitere Verbindung, ATP, wird von den Zellen verwendet, um Energie zu produzieren.
Was sind seine Einsatzmöglichkeiten?
BearbeitenPhosphor wird in Dünge- und Reinigungsmitteln verwendet. Phosphorsäure (H3PO4) wird Getränken beigemischt, um den Geschmack zu verbessern. Einige Phosphorverbindungen werden verwendet, um Glühbirnen und Fernsehgeräte herzustellen. Phosphor wird auch verwendet, um innen Leuchtstäbe herzustellen. Phosphor wurde im Zweiten Weltkrieg zum Bau von Brandbomben verwendet.
Ist es gefährlich?
BearbeitenWeißer Phosphor ist sehr giftig und ist sehr schädlich für das menschliche Gewebe, insbesondere für Knochen und Knorpel.
-
entzündbar
-
akut giftig
-
ätzend
-
Umwelt
== Platin ==
 |
 |
Die Position von Platin im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie riecht es, wie schmeckt es?
Bearbeiten
Platin ist ein silberweißes Schwermetall. Es hat mit 1768°C einen höheren Schmelzpunkt als die Flamme eines Bunsenbrenners. In der Flamme glüht Platin mit rötlich-oranger Farbe.
Wie wurde Platin entdeckt?
BearbeitenPlatin kommt häufig gemeinsam mit anderen Metallen vor. Die Ägypter stellten aus einer Goldlegierung, die auch Platin enthielt, Schmuck her.
Auch die südamerikanischen und präkolumbianischen Indianern verarbeiteten Gold-Platin-Legierungen. Mitte des 16. Jahrhundert wurde Platin aus Südamerika nach Europa eingeführt.
Platin kommt selten in Form von Nuggets vor.
Woher kommt der Name?
Bearbeiten- Wusstest du, dass...
- Platin ein sehr teueres Edelmetall ist?
- eine Mischung von Wasserstoff und Sauerstoff zu brennen anfängt, sobald sie mit Platin in Kontakt kommt?
Der Name stammt von dem spanischen Wort platina (d.h. "kleines Silber").
Im 16. und 17. Jahrhundert war Platin für die Spanier ein Ärgernis, denn Goldfälscher mischten Gold mit dem damals billigen Platin ("kleines Silber").
Aus dieser Gold-Platin-Legierung konnte man damals noch nicht das reine Gold extrahieren. Und bei der Schmuckherstellung hatte man Probleme, weil diese Legierung sich nur schwer verarbeiten lässt.
Wo wird es gefunden?
BearbeitenPlatin wird in Südamerika und Russland gefunden. Es fällt als Nebenprodukt des Nickel- und Kupfer-Bergbaus an.
Welche Einsatzmöglichkeiten gibt es?
BearbeitenPlatin wird in Schmuck, Laborgeräten, elektrischen Kontakten und in der Zahnmedizin eingesetzt. Es wird auch in dem Katalysator im Auto verwendet. Früher wurden Platinfeuerzeuge hergestellt, bei denen Platin als Katalysator die Flamme entzündete, sobald das Wasserstoffgas ausströmte.
Weil Platin nach Gold heutzutage das zweitteuerste Edelmetall ist, gab und gibt es Platinmünzen.
Ist es gefährlich?
BearbeitenDurchaus. Bei einem langfristigen Kontakt können Allergien ausgelöst werden. Platinstücke sind nicht brennbar, Platinpulver kann brennen
-
entzündbar
== Plutonium ==
 |
 |
Die Position von Plutonium im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie riecht es, wie schmeckt es?
BearbeitenPlutonium ist ein silbriges Metall. Ein großes Stück Plutonium fühlt sich warm an und größere Stücke produzieren sogar genug Hitze, um Wasser zu kochen. Die Wärme stammt vom radioaktiven Zerfall des Plutoniums.
Plutonium ist äußerst giftig (siehe unten). Den Geschmack zu prüfen wäre Selbstmord!


Plutonium ist ein radioaktives, metallisches und giftiges chemisches Element. Es hat das Symbol Pu und die Ordnungszahl 94. Es ist ein spaltbares Element und wird zum Bau der meisten modernen Atomwaffen verwendet.
Das wichtigste Plutonium-Isotop ist 239Pu. Es hat eine Halbwertszeit von 24.100 Jahren. Aufgrund seiner niedrigen Halbwertszeit hat man es nirgendwo in der Natur gefunden. Es kann aber in einem Kernkraftwerk aus natürlichem Uran hergestellt werden.
Das stabilste Isotop ist 244Pu, mit einer Halbwertszeit von etwa 80 Millionen Jahren. Es entsteht in der Natur durch den Zerfall anderer Elemente und kann in äußerst geringen Mengen in der Natur gefunden werden.
Wie wurde Plutonium entdeckt?
BearbeitenPlutonium wurde im Jahr 1940 hergestellt.

Woher kommt der Name?
BearbeitenPlutonium wurde nach Pluton benannt. Pluton ist der römische und griechische Gott der Totenwelt. Nach ihm wurde auch der Zwergplanet Pluto benannt.
Wo wird es gefunden?
BearbeitenPlutonium wird in der Regel künstlich in speziell ausgelegten Reaktoren hergestellt, die speziell für diese Aufgabe gebaut wurden. Winzige Spuren von Plutonium wurden in der Natur auch in einigen Uran-Erzen gefunden.
Welche Einsatzmöglichkeiten gibt es?
Bearbeiten- Wusstest du, dass...
- ein Kilogramm Plutonium 22 Millionen Kilowattstunden Wärmeenergie produziert?
Die bekannteste Verwendung von Plutonium ist der Bau von Atomwaffen und Kraftwerke unter Verwendung seines Isotops 239. Es ist eines der wichtigsten Stoffe, die nukleare Explosionen verursachen.
Es wird auch für den Bau von langlebigen Batterien für Raumsonden und Satelliten verwendet und es wurde früher auch für Herzschrittmacher benutzt.
Ist es gefährlich?
BearbeitenJa!!!

Plutonium ist sowohl radioaktiv als auch sehr giftig. Personen, die mit geringen Mengen von Plutonium in Kontakt gekommen sind haben eine erhöhte Wahrscheinlichkeit Krebs zu bekommen. Es ist hochgiftig und darf nicht berührt, und auf keinen Fall verschluckt oder eingeatmet werden.
Plutonium wird in den mächtigsten und tödlichsten Waffen aller Zeiten, den Atom- und Wasserstoffbomben eingesetzt. (Eine GHS-Einteilung wurde nicht vorgenommen, obwohl Plutonium giftig und gesundheitsschädlich ist.)
== Quecksilber ==
 |
 |
Die Position von Quecksilber im Periodensystem der Elemente.
|
Die Werte.
|
Wie es aussieht, sich anfühlt, riecht oder schmeckt
Bearbeiten
Quecksilber ist ein silberfarbiges Metall, das bei Raumtemperatur flüssig ist. Wegen der hohen Kohäsionskräfte formt es sich auf einem anderen Stoff schnell zu Perlen. Es hat eine hohe Dichte, das heißt, dass selbst eine kleine Menge davon schon ziemlich schwer ist. Wegen der starken Giftigkeit des Quecksilbers sollte man nicht nahe daran riechen oder sogar versuchen zu schmecken.
Wie es entdeckt wurde
BearbeitenQuecksilber ist schon seit der Antike bekannt. Bereits die Chinesen und Hindus kannten es. Tatsächlich fand man in einem Grabmal eines chinesischen Kaisers eine Karte von China, deren Seen aus Quecksilber gemacht wurden.
Woher der Name kommt
BearbeitenQuecksilber wird so genannt, weil es wie flüssiges Silber aussieht. Der lateinische Name hydrargyrum bedeutet "flüssiges Silber".
- Wusstest du, dass...
- Die Hälfte des Quecksilbers auf der Welt aus Italien und Spanien kommt?
- Quecksilber in 3500 Jahre alten ägyptischen Gräbern gefunden wurde?
- man Ärzte, die ihre Patienten unabsichtlich mit einer quecksilberhaltigen Medizin vergiftet hatten, Quacksalber nannte?
- Zahnärzte eine Verbindung des Quecksilbers mit anderen Metallen, wie Silber, Kupfer, Zinn und Zink als Amalgam zur Füllung von Löchern in den Zähnen einsetzten?
Wo man Quecksilber findet
BearbeitenQuecksilber ist sehr selten, man findet es meistens im Vulkangestein Zinnober. Die größten Quecksilbervorkommen sind bereits abgebaut.
Für was es verwendet wird
BearbeitenQuecksilber wurde früher für Thermometer verwendet. Weil Quecksilber sehr gesundheitsschädlich ist, darf es heute in Thermometern nicht mehr benutzt werden. Es wird aber in geringen Mengen noch in Energiesparlampen und Leuchtstoffröhren verwendet. Als Quecksilberchlorid (Hg2Cl2), auch Kalomel (das bedeutet „schönes Schwarz“) genannt, wird es als Desinfektionsmittel verwendet. Quecksilbersulfid (HgS) wird in der Kunst als Zinnoberrot verwendet. Quecksilberbatterien werden aus Quecksilberoxid (HgO) gemacht.
Ob Quecksilber gefährlich ist
BearbeitenQuecksilber ist sehr giftig. Es kann über die Atemwege, den Magen oder die Haut in den Körper gelangen, was zu Krankheit oder sogar zum Tod führen kann. Quecksilberverschmutzung ist ein Problem, weil es über die Nahrung, vor allem der aus dem Meer, zu uns gelangen kann. Quecksilber ist ein schleichendes Gift, dessen Auswirkungen erst nach längerer Zeit auftreten, meistens als Schädigung des Gehirns.
-
akut giftig
-
Umwelt
-
Gesundheitsgefahr
== Radon ==
 |
 |
Die Position von Radon im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus, wie fühlt es sich an, wie schmeckt oder riecht es?
BearbeitenRadon ist ein unsichtbares und geruchloses Gas. Du kannst es also nicht sehen, riechen oder schmecken.

Wie wurde es entdeckt?
BearbeitenRadon wurde 1900 von Friedrich Ernst Dorn entdeckt. Er nannte das Gas ursprünglich "Radium-Emanation". Später hieß es "Niton" und ab 1923 "Radon". Es wurde nach dem Element Radium benannt.
- Wusstest du, dass...
- Radon das schwerste Edelgas ist?
- es ursprünglich Radium-Emanation hieß?
- Radon nach Rauchen die zweithäufigste Ursache für Lungenkrebs ist?
Wo kommt es vor?
BearbeitenRadon kommt in ganz kleinen Mengen in der Luft vor. Aber ursprünglich kommt es aus dem Boden. Es wird beim Zerfall von Uran im Gestein und im Boden freigesetzt. Radon bildet sich, wenn das Radium in der Erdkruste zerfällt.
Was kann man damit machen?
BearbeitenRadon bildet sich in uranhaltigem Gestein und sammelt sich in Hohlräumen. Schon bei leichten Erschütterungen der Erdkruste gelangt es an die Oberfläche und kann dort nachgewiesen werden. Deshalb wird es auch für die Vorhersage von Erdbeben genutzt. (Schweren Erdbeben gehen oft kleine Beben voraus.)
Radon wird auch verwendet, um bestimmte Formen von Krebs zu behandeln.
Ist es gefährlich?
BearbeitenRadon ist hoch radioaktiv. Untersuchungen der National Academy of Sciences (USA) haben gezeigt, dass Radon die zweithäufigste Ursache für Lungenkrebs nach Rauchen ist.
-
radioaktiv
== Sauerstoff ==
 |
 |
Die Position von Sauerstoff im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Sauerstoff aus? Wie riecht oder schmeckt er? Und wie fühlt er sich an?
BearbeitenReiner Sauerstoff kommt in zwei verschiedenen Formen vor, nämlich als Verbindung zwischen zwei (O2) oder drei Sauerstoff-Atomen (O3).
- O2 ist normalerweise ein farbloses Gas, aber unterhalb von −182,97 °C ist es eine blaue Flüssigkeit.
- O3 heißt Ozon und ist ein giftiges Gas mit einem stechenden Geruch.
Wie er entdeckt wurde
BearbeitenIm Jahre 1772 entdeckte Carl Wilhelm Scheele, dass beim Erhitzen bestimmter Mineralien ein Gas entstand, das Verbrennungsprozesse viel stärker förderte als normale Luft. Er war auch in der Lage, das Gas in seiner reinen Form zu speichern, um damit zu experimentieren. Jedoch wartete er einige Jahre damit, seine Arbeit zu veröffentlichen.
Etwa zur gleichen Zeit, nämlich 1774, führte Joseph Priestley ähnliche Experimente zur Erzeugung und Speicherung des Gases durch. So wie Scheele zeigte er die Fähigkeit des Gases auf, Verbrennungsprozesse besser zu fördern als Luft. Er veröffentlichte seine Arbeit ohne zu zögern und galt damit als Entdecker des Elements Sauerstoff.
Woher sein Name kommt
BearbeitenIm Englischen wird Sauerstoff „Oxygen“ genannt. Dieser Name kommt aus dem Griechischen und bedeutet „Säure-bildend“. (gr. „oxys“ = sauer; „-genos“ = erzeugend). Im Deutschen wurde „oxys“ direkt mit „Sauer“ übersetzt. Als das Element seinen Namen erhielt, dachten die Wissenschaftler noch, jede Säure enthalte Sauerstoff – heute wissen wir, dass dies nicht ganz richtig ist.
- Wusstest du, dass...
- Sauerstoff das häufigste Element in der Erdkruste ist?
- der meiste Sauerstoff in unserer Atmosphäre durch Photosynthese in Pflanzen oder Biosynthese in Bakterien entstanden ist?
- Sauerstoff das dritthäufigste Element in unserem Universum ist?
- dein Körper etwa zu 61% aus Sauerstoff besteht?
Wo wir ihn finden
BearbeitenSauerstoff ist sehr häufig anzutreffen, aber nur in der Atmosphäre ist er als ungebundenes Element zu finden. Die Luft, die wir atmen, enthält 21% Sauerstoff. Meistens ist er aber an andere Elemente gebunden:
- Wasserstoff und Sauerstoff bilden Wasser (H2O)
- Wenn Stoffe verbrennen, die Kohlenstoff enthalten – z.B. Holz oder Kohle – entsteht Kohlendioxid (CO2)
- Sehr viele Mineralien enthalten Sauerstoff – z.B. Sand und Erze, aus denen Metalle gewonnen werden.
Wofür brauchen wir ihn?
Bearbeiten
Ohne Sauerstoff wäre das Leben, wie wir es kennen, gar nicht möglich. Unter allen Lebewesen gibt es nur ein paar Mikroben, die ohne ihn auskommen. Alle anderen Lebewesen sind vom Sauerstoff abhängig. Sogar winzige Bakterien und Pilze brauchen ihn. Die Tiere und wir Menschen müssen ihn einatmen, um zu überleben, denn in unseren Muskeln und in unserem Gehirn werden Sauerstoff und Traubenzucker verbrannt, um unserem Körper Energie zu liefern – ohne Sauerstoff müssten wir sterben. Auch Fische müssen „atmen“ – im Wasser ist immer etwas Sauerstoffgas gelöst – Fische filtern mit ihren Kiemen den Sauerstoff aus dem Wasser. Pflanzen erzeugen Sauerstoff! Mit ihren Blättern nehmen sie Kohlendioxid aus der Atmosphäre auf und mit der Energie des Sonnenlichts trennen sie Kohlenstoff und Sauerstoff.
Reiner Sauerstoff sorgt dafür, das Verbrennungen um ein vielfaches stärker ablaufen als in normaler Luft. In der Technik gibt es viele Anwendungen für reinen Sauerstoff, nämlich dort, wo viel Energie freigesetzt werden soll:
- in einigen Raketen werden flüssiger Sauerstoff und Wasserstoff als Treibstoff verwendet.

- Bei einer bestimmten Schweißtechnik werden Sauerstoff und ein Gas verbrannt, das Acetylen heißt. Mit der Hitze der Flamme werden Metalle wie Stahl geschmolzen. Dabei verbinden sich die Metallteile sehr fest miteinander. Stahl schmilzt bei etwa 1300 bis 1500 °C, die Flamme des Schweißbrenners ist sogar 3200 °C heiß!
Ist er gefährlich?
BearbeitenSauerstoff ist giftig - und lebenswichtig! - Wie kann das sein?
Sauerstoff steht, nach Fluor und Chlor, an dritter Stelle der reaktionsfreudigen nichtmetallischen Elemente.
(+) Sauerstoff ist lebenswichtig, weil Reaktionen mit ihm viel Energie erzeugen. Diese Energie benötigen wir.
(-) Sauerstoff reagiert so leicht, dass es uns vergiften kann, aber wir Menschen verfügen über ausreichend gute Schutzmechanismen, um mit den 20 % Sauerstoff in der Luft zurecht zu kommen. (Bei normalem Druck.)
Vor allem Taucher sind gefährdet, denn sie atmen Sauerstoff mit hohem Druck. Eine Gefahr ist, dass die Lungenbläschen anschwellen, und man nicht mehr atmen kann. Eine andere Gefahr ist die Vergiftung des Nervensystems. Ist zu viel Sauerstoff im Blut kann das giftige Abfallprodukt Kohlendioxid (CO2) nicht mehr schnell genug abtransportiert werden.
Ozon O3 ist eine extrem seltene Form von Sauerstoff, die Atmosphäre enthält nur 0,0000004% davon (das wären 0,1 Liter von der Luft einer mittelgroßen Wohnung, wenn das Ozon gleichmäßig in der Atmosphäre verteilt wäre). Etwa 90 % des Ozons befinden sich hoch oben in der Stratosphäre in einer Höhe von 20-30 Kilometern und bilden die sogenannte „Ozonschicht“.

Die Ozonschicht ist ein wichtiger Schutzschild und filtert gefährliche ultraviolette Strahlung aus dem Sonnenlicht. Über der Antarktis ist die Ozonschicht deutlich schwächer, man spricht von einem „Ozonloch“. Weil Australien so nahe an der Antarktis liegt, ist dort die ultraviolette Strahlung besonders stark. Australien hat deshalb die meisten Hautkrebserkrankungen der Welt, mit steigender Tendenz.
Ozon kann aber auch in der Nähe der Erdoberfläche entstehen, vor allem in der Umgebung von Städten mit hoher Umweltverschmutzung, besonders an heißen Tagen. In den Nachrichten wird dann vor „Sommersmog“ gewarnt.
Wenn wir zu viel Ozon einatmen, kann es zu Kopfschmerzen und Reizung der Augen und der Schleimhäute im Hals kommen. Die Leistungsfähigkeit des Körpers lässt nach. Wenn man besonders viel davon einatmet, kann Ozon Entzündungen in der Lunge auslösen. Deshalb sollte man bei „Ozon-Alarm“ jede Anstrengung vermeiden.
-
wirkt entzündend
== Schwefel ==
 |
 |
Die Position von Schwefel im Periodensystem der Elemente.
|
Die Werte.
|


Wie sieht er aus? Wie riecht er, wie schmeckt er?
BearbeitenSchwefel ist gelb und besteht aus großen Kristallen. In reiner Form ist er geruch- und geschmacklos, aber viele Stoffe, die aus Schwefel bestehen, stinken. Die Gerüche von faulen Eiern, abgebrannten Streichhölzern oder Stinktieren stammen alle von schwefelhaltigen Inhaltsstoffen.
Wie wurde er entdeckt?
BearbeitenSchwefel wurde bereits sehr früh entdeckt. In der Bibel wird er mit dem Teufel und der Hölle in Verbindung gebracht.
Woher kommt der Name?
BearbeitenDas Wort Schwefel hat alte Wurzeln. Aus dem altlateinischen Wort für Schwefel, sulpur, entwickelte sich im Laufe der Zeit das deutsche Wort Schwefel. Der alte lateinische Name stammt vermutlich von dem Sanskrit Wort Sulvere ab, was schlafen bedeutet. (Wenn man giftige Schwefelverbindungen einatmet, kann man für immer "schlafen".)
Wo kann man ihn finden?
Bearbeiten- Wusstest du, dass...
- Schwefel mit einer blauen Flamme brennt?
- Schwefel bei 444,4°C (832°F) siedet und bei 115°C (239°F) schmilzt?
- auch wenn fester Schwefel strahlend gelb ist, hingegen geschmolzener Schwefel blutrot ist?
- Schwefel ein wichtiger Bestandteil von Eiweiß ist?
- Schwefelverbindungen verantwortlich für den üblen Geruch bei Blähungen sind?
In der Natur kommt Schwefel sowohl als reines Element, als auch in Kombination mit anderen Elementen als Mineral vor. Schwefel kommt vor allem in Vulkangebieten vor. Außerdem findet man ihn in Meteoriten und heißen Quellen. Schwefel ist weit verbreitet und kann auf der ganzen Welt gefunden werden. Eine Verbindung des Schwefels (Schwefelwasserstoff oder H2S) kommt in kleinen Mengen im Erdöl und Erdgas vor. Beim Verbrennen entstehen umweltschädliche Schwefeloxide. Der Schwefelwasserstoff wird deshalb entfernt. In Ölraffinerien wird als Nebenprodukt das H2S) gewonnen.

Welche Einsatzmöglichkeiten gibt es?
BearbeitenSchwefel wird verwendet, um Streichhölzer und Schießpulver herzustellen. Er wird auch verwendet, um Pflanzendünger zu produzieren. Schwefeldioxid (SO2,) wird verwendet, um getrocknete Früchte zu konservieren und um Schwefelsäure (H2SO4,) herzustellen, dass die Industrie in großen Mengen benötigt. Etliche Verbindungen des Elements Schwefel sind lebenswichtig. Man kann Fäden in geschmolzenen Schwefel tauchen und diese Fäden nach dem Abkühlen anzünden. Dabei entsteht ein giftiges, ätzendes Gas namens Schwefeloxid. Da dieses giftige Gas Bakterien tötet, wurden die brennenden Fäden früher zur Desinfektion in Weinfässer gehängt und diese dann verschlossen.
Kautschuk, der aus dem Milchsaft der Kautschukbäume hergestellt wird, wird mit der Zeit hart und brüchig. Bei warmen, feuchten Wetter wird er klebrig. Erst durch den Zusatz von Schwefel (dem sogenannten vulkanisieren) wird aus dem Naturprodukt Kautschuk ein haltbarer und elastischer Gummi.

Ist Schwefel gefährlich?
BearbeitenSchwefel ist ungiftig, aber viele Verbindungen sind sehr gefährlich. Schwefelwasserstoff oder (H2S) ist ein starkes Atemgift. Schwefelsäure (H2SO4,) ist stark ätzend. Schwefel ist ein wichtiger Bestandteil des Schießpulvers.
-
Achtung
-
entzündbar
== Silber ==
 |
 |
Die Position von Silber im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus, wie fühlt es ich an, wie schmeckt es oder riecht es?
Bearbeiten
Silber ist ein weiches Metall, das einen brillanten, weißen Glanz hat. Silber ist ein wenig härter als Gold. Silbererz sieht ein bisschen wie Granit aus, wenn es abgebaut wurde.
Silber hat einen süßen und säuerlichen Geschmack.
Wie wurde es entdeckt?
BearbeitenSilber ist seit der Antike bekannt. In der Bibel wird Silber in der Genesis erwähnt. Man lernte ca. 3.000 v. Chr. in Kleinasien und auf den Inseln des Ägäischen Meeres, wie man Silber von Blei trennen kann.
Woher hat Silber seinen Namen?
BearbeitenSilber hat seinen Namen von den angelsächsischen seolfor. Im Lateinischen nannte man Silber argentum.
- Wusstest du, dass...
- Silber besser Strom leitet als alle anderen Metalle?
- Silber das weißeste Metall ist?
- Silber der beste bekannte Reflektor des sichtbaren Lichts ist?
Wo kommt es vor?
BearbeitenMexiko ist derzeit der weltweit größte Produzent von Silber. Weitere wichtige Silber produzierende Länder sind Kanada, Peru und die Vereinigten Staaten.
Silber ist in Erzen wie Argentit, hellem Rubin Silber, dunkles Rubinrot Silber und sprödem Silber vorhanden.
Was sind seine Verwendungen?
Bearbeiten
Silber wird für Schmuck und Geschirr verwendet. Es wird seit Jahrhunderten in der Münzherstellung verwendet. Silber wird auch in guten Spiegeln verwendet, aber diese Spiegel müssen eine Schutzschicht tragen, um sie vor dem Anlaufen zu schützen. Einige Batterien, die viel Energie speichern können, werden mit einer Kombination von Silber und Zink oder Silber und Cadmium betrieben.
Reines Silber wird schon seit dem 17. Jahrhundert als Geldanlage verwendet.
Silberbromid (AgBr) wird verwendet, um Filme zu machen. Auch Silbernitrat (AgNO3) wird verwendet, um fotografische Filme und Bilder zu machen.
Silberchlorid kann transparent gemacht werden und kann auch als Zement für Glas verwendet werden.
Silber kann verwendet werden, um Stromkabel herzustellen Es kann besser Strom leiten als jedes andere Metall.
Silberjodid (AgI) kann verwendet werden, um künstliche Wolken zu erzeugen. Es wird auch in der Fotografie verwendet.
Ist es gefährlich?
Bearbeiten
Von reinem Silber geht keine Gesundheitsgefahr aus, aber wenn es mit anderen Elementen gemischt wird kann es Krebs verursachen. Silbersalze sind giftig. Wenn Silberverbindungen durch das Kreislaufsystem aufgenommen werden, kann dies zu einer Argyrie (ein Ergrauen der Pigmentierung der Haut und Schleimhäute) führen. (Silber ist ungefährlich, kein GHS-Piktogramm.)
== Silicium ==
 |
|
Die Position von Silicium im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus?
Bearbeiten
Silicium ist ein dunkelgrauer, metallisch glänzender Feststoff.
Wie wurde Silicium entdeckt?
BearbeitenSilicium wurde von mehreren Chemikern unabhängig voneinander hergestellt, zuerst im Jahr 1787 von Antoine Lavoisier. Es wurde im Jahr 1824 von Jöns Jacob Berzelius erneut entdeckt und untersucht. Dabei erkannte er, dass Silicium ein Element ist.
Woher kommt der Name?
BearbeitenSilicium hat seinen Namen von silicis, das ist lateinisch Name für Feuerstein. (Feuersteine enthalten Silicium.)
- Wusstest du, dass...
- Silicium nach Sauerstoff das zweithäufigste Element in der Erdkruste ist?
Wo wird es gefunden?
BearbeitenEin Viertel der Erdkruste besteht aus Silicium. Silicium wird nicht frei in der Natur gefunden, sondern tritt hauptsächlich als Siliciumdioxid in Form von Sand, Quarz, Bergkristall, Amethyst, Achat, Feuerstein, Jaspis und Opal auf.
Meerwasser enthält winzige Mengen von Kieselsäure. Viele Einzeller stellen daraus glasartige Panzer und Stacheln her. Silikat-Minerale sind Salze der Kieselsäure. Man findet sie in Granit, Feldspat, Ton und Glimmer.
In Meteoriten findet man elementares Silicium.
Welche Einsatzmöglichkeiten gibt es?
Bearbeiten

Silicium ist eines der nützlichsten Elemente. In Form von Sand und Ton wird es verwendet, um Beton und Ziegel herzustellen. Silikate werden auch bei der Herstellung von Emaille und Keramik verwendet. Sand ist der Hauptbestandteil von Glas. Aus Glas werden Flaschen, Fenster, Linsen und Tausende von anderen Objekten hergestellt.
Siliciumchips werden in Transistoren, Solarzellen, Mikroprozessoren und anderen elektronischen Geräten verwendet.
Silicium ist ein wichtiger Bestandteil des Stahls.
Einige Schleifpapiere werden mit Siliciumkarbid beschichtet.
Ist es gefährlich?
BearbeitenNein, Silicium ist in der Regel nicht gefährlich, aber bei Bergleuten und Steinmetzen ist eine ernsthafte Lungenerkrankung, Silikose bekannt, die entsteht, wenn sie zu viel Silikatstaub einatmen. Die scharfen Kanten der Silikatpartikel reißen Löcher in die Lungenbläschen.
-
entzündbar
-
Achtung
== Stickstoff ==
 |
 |
Die Position von Stickstoff im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie riecht es, wie schmeckt es?
BearbeitenStickstoff ist ein farb- und geruchloses Gas.
Wie wurde er entdeckt?
BearbeitenDer schottische Physiker Daniel Rutherford hat 1772 Stickstoff entdeckt.

- Wusstest du, dass...
- Stickstoff mit einem Anteil von etwa 78% das häufigste Element in der Atmosphäre ist?
- Stickstoff ein wichtiger Bestandteil von Eiweiß ist?
- einige Pflanzen eine Partnerschaft (Symbiose) mit Bakterien eingehen, damit diese Stickstoff aus der Luft für die Eiweißgewinnung liefern?
Woher kommt der Name?
BearbeitenIn reinem Stickstoff verlöschen Flammen und ersticken Tiere.
Wo wird er gefunden?
BearbeitenStickstoff ist das weltweit fünft häufigste Element. Stickstoff findet man gasförmig in der Atmosphäre und auch als Bestandteil des Eiweißes sowie der DNS in Lebewesen. Anorganische Abbauprodukte von Proteinen findet man in der Verbindung Ammonium oder Nitrat und in geringer Menge Nitrit in der Natur.
Welche Einsatzmöglichkeiten gibt es?
Bearbeiten

Stickstoffverbindungen werden von allen Lebewesen zu Herstellung von Proteinen und DNA benötigt. Stickstoffdünger hilft Pflanzen beim Wachsen. Auch organische Abfälle (Kompost, Mist, Jauche) enthalten Stickstoffsalze.
"Lachgas" ist eine Verbindung von Stickstoff und Sauerstoff. Es wird als Narkosemittel eingesetzt.
Salpetersäure und Ammoniak sind für die Industrie wichtige Chemikalien. Sie enthalten Stickstoff.
Ist es gefährlich?
BearbeitenStickstoff ist ungiftig, aber zum Atmen benötigen Menschen und Tiere Sauerstoff.
Flüssiger Stickstoff ist sehr kalt und kann Erfrierungen hervorrufen.
Die wichtigsten Sprengstoffe (z.B. Nitroglycerin, dass ist der Wirkstoff im Dynamit) sind Verbindungen von Stickstoff.
Dekompression
Wenn Taucher längere Zeit tief tauchen, löst sich im Blut Stickstoff auf. Während sie langsam wieder auftauchen und "Dekompressionspausen" machen, verlässt der Stickstoff wieder das Blut und wird ausgeatmet. Wenn sie zu schnell auftauchen besteht Lebensgefahr. So wie in einer Sprudelflasche, die man geschüttelt hat, Blasen entstehen, so entstehen Stickstoffblasen im Blut. Die Taucher müssen unverzüglich in eine Druckkammer gebracht werden.
-
Gasflasche
== Titan ==
 |
 |
Die Position von Titan im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie riecht es, wie schmeckt es?
BearbeitenTitan ist ein silbrig glänzendes Metall. Es ist relativ leicht und sehr fest.


Wie wurde Titan entdeckt?
BearbeitenTitan wurde in Cornwall in England vom Amateur-Geologen William Gregor im Jahre 1791 entdeckt. Er nannte es zunächst Menachite. Es wurde vier Jahre später erneut von deutschen Chemiker Martin Heinrich Klaproth entdeckt, der es als Titan bezeichnete.
Woher kommt der Name?
BearbeitenTitan ist aufgrund seiner Härte nach den Titanen der griechischen Mythologie benannt.
- Wusstest du, dass...
- Titan eines der wenigen Metalle ist, mit denen sich Knochen verbinden? Deshalb bestehen künstliche Gelenke häufig aus Titan.
Wo wird es gefunden?
BearbeitenTitan kommt auf der Erde nicht als Element sondern nur als Verbindung mit anderen Elementen vor. Diese Verbindungen findet man an vielen Orten der Erde, aber es ist kompliziert, daraus reines Titan zu gewinnen. Titan wird in Asteroiden und im Mondgestein gefunden.
Welche Einsatzmöglichkeiten gibt es?
BearbeitenDa Titan ist ein festes, dehnbares und leichtes Metall ist, gibt es viele Anwendungsmöglichkeiten. Titan wird in Flugzeugen, Schiffen, Rennrädern und Raumfahrzeugen verwendet. Es kann auch in einigen Computern, Golfschlägern und Tennisschlägern gefunden werden.
Titan ist ungiftig und verträgt sich gut mit Knochen und Körpergewebe. Deshalb wird es für Prothesen verwendet.

Die Verbindung Titandioxid wird als weiße Farbe verwendet.
In Nebelkerzen bildet sich durch eine chemische Reaktion Titandioxid - Rauch.
Ist es gefährlich?
BearbeitenDas Metall Titan ist harmlos. In Pulverform kann es brennen oder explodieren.
-
entzündbar
== Uran ==
 |
 |
Die Position von Uran im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Uran aus, schmeckt und riecht es?
Bearbeiten

Uran ist ein silbrig-weißes Metall welches auch leicht bläulich erscheinen kann.
Wie wurde es entdeckt?
BearbeitenUran wurde 1798 von Martin Klaproth, einem deutschen Chemiker, entdeckt. Er entdeckte das Element während er Proben des Minerals Pechblende analysierte. Die Probe war aus dem Bergwerk „Georg Wagsfort“ in Wittigstal bei Johanngeorgenstadt in Sachsen gemacht. Die Radioaktivität von Uran entdeckte Henri Becquerel im Jahr 1896.
Woher kommt der Name?
BearbeitenDas Element Uran wurde nach dem Planeten Uranus, welcher 1781 von William Herschel entdeckt wurde benannt.
- Wusstest du, dass...
- Uran mit der Ordnungszahl 92 das höchste Element im Periodensystem ist, welches in abbaubaren Mengen auf der Erde vorkommt?
- eine Tonne Uran 40 Millionen Kilowattstunden Strom liefert? Das ist dieselbe Menge Strom die aus 16.000 Tonnen Kohle oder aus etwa 13.000.000 Liter Erdöl gewonnen wird.
- die Ureinwohner Amerikas welche auf dem Colorado Plateau leben das uranhaltiges Erz Carnotit verwenden, um leuchtend gelbe Farben herzustellen?
Wo findet man Uran?
BearbeitenUran kann weltweit in Bergen oder im Boden gefunden werden. In Australien liegen die größten Uranvorkommen.
Wofür wird es verwendet?
BearbeitenUran wird üblicherweise in Nuklearreaktoren zur Stromerzeugung, sowie in Atombomben als Waffe verwendet.
Uran wird zur Altersbestimmung von Gesteinen verwendet.
Uran wird in Farben und Glasuren verwendet, obwohl diese Verwendung heute sehr selten ist.
Uran kann zum Färben von Glas verwendet werden. Solches Uranglas ist gelb gefärbt und leuchtet unter UV-Licht grün.
Ist es gefährlich?
BearbeitenReines Uran kann explosionsartig verbrennen. Uranverbindungen sind giftig und da Uran radioaktiv ist, kann es zu Krebs führen.
Uran ist nicht gleich Uran, denn Uran kann im Atomkern unterschiedlich viele Neutronen enthalten. Diese unterschiedlichen Urantypen nennt man Isotope. Natururan enthält Isotope, die relativ wenig radioaktive Strahlung abgeben. In Kernkraftwerken entstehen Isotope, die hochradioaktiv und sehr gefährlich sind.
-
Achtung strahlend / Strahlung
== Vanadium ==
 |
 |
Die Position von Vanadium im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie riecht es, wie schmeckt es?
BearbeitenVanadium ist ein blaugrau glänzendes Metall.
- Wusstest du, dass...
- Vanadium ein lebenswichtiger Stoff ist?
Wie wurde Vanadium entdeckt?
BearbeitenAndrés Manuel del Río hat 1801 Vanadium hergestellt.


Woher kommt der Name?
BearbeitenVanadium hat seinen Namen von dem Mineral Vanadit.
Wo wird es gefunden?
BearbeitenVanadiumerz wird in Südafrika, China und Russland gefördert.
Welche Einsatzmöglichkeiten gibt es?
Bearbeiten
Vanadium wird für die Herstellung von sehr widerstandsfähigen Metallen eingesetzt. Es wird auch als Katalysator bei der Herstellung von Schwefelsäure benutzt. Vanadium spielt bei vielen Vorgängen in Lebewesen eine wichtige Rolle. So benötigen Pflanzen Vanadiumsalz um mit Hilfe von Blattgrün die Sonnenenergie nutzen zu können.
Ist es gefährlich?
BearbeitenVanadium ist harmlos, aber einige Vanadiumverbindungen sind krebserregend.
(Keine GHS-Gefahrstoffkennzeichnung)
== Wasserstoff ==
 |
 |
Die Position von Wasserstoff im Periodensystem der Elemente.
|
Die Werte.
|
Wasserstoff ist das leichteste und am häufigsten vorkommende Element im Universum. Es macht ungefähr 75% der Masse des Universums aus (dunkle Materie nicht dazugezählt). Das Wasserstoffatom ist das kleinste aller Atome; es besteht nur aus einem Proton und einem einzigen Elektron. Das Elementsymbol für Wasserstoff ist H. Im Periodensystem findest du es ganz oben links.
Wie sieht Wasserstoff aus? Wie riecht und schmeckt er? Und wie fühlt er sich an?
Bearbeiten
Wasserstoff besitzt von allen chemischen Elementen das kleinste Atom mit einem winzigen Durchmesser von nur 0,000000000031 m. Bei Zimmertemperatur ist Wasserstoff ein durchsichtiges Gas. Weil Wasserstoff sehr reaktionsfreudig ist, existiert H als einzelnes Wasserstoffatom nur für einige Picosekunden (Picosekunden sind Millionstel einer Millionstel Sekunde), dann verbinden sich zwei Wasserstoffatome zu einem Wasserstoffmolekül H2. Das Wasserstoffgas hat weder einen Geschmack noch einen Geruch und ist ungiftig. Durch sehr, sehr niedrige Temperaturen und sehr hohen Druck kann Wasserstoffgas in eine Flüssigkeit oder sogar einen Feststoff umgewandelt werden. Eine häufige Verbindung, die Wasserstoff enthält, ist H2O (Wasser). Es enthält zwei Wasserstoffatome und ein Sauerstoffatom und ist bei Zimmertemperatur eine klare, durchsichtige Flüssigkeit, eben Wasser.
Wie er entdeckt wurde
BearbeitenHenry Cavendish war der Erste, der verstand, dass Wasserstoff eine einzigartige Substanz ist. 1766 produzierte er Wasserstoff, indem er Quecksilber mit einer Säurelösung mischte. Jedoch wurde Wasserstoff auch schon im Jahre 1520 von dem Schweizer Alchemisten Paracelsus hergestellt, der ebenfalls Metall mit einer starken Säure mischte und ein leicht entzündliches Gas erzeugte.
Wie der Wasserstoff zu seinem Namen kam
BearbeitenDas Element wurde von dem Franzosen Antoine Lavoisier so benannt, weil Wasserstoff, wenn er verbrennt, zu Wasser wird. Das lateinische Wort hydrogenium heißt auf Deutsch Wassererzeuger. Deshalb hat Wasserstoff Symbol H.
- Wusstest du, dass...
- Wasserstoff das kleinste Atom ist?
- Wasserstoff das häufigste Element im Universum ist?
- Wasserstoff der Hauptbrennstoff in Sternen und der einzige Brennstoff für Rote Zwerge ist?
- Wasserstoff zukünftig vielleicht als Kraftstoff für Autos verwendet wird?
- Wasserstoff gewöhnlich nicht in reiner Form auf der Erde vorkommt, sondern als Bestandteil von Molekülen (z.B. Wasser)?
- Wasserstoffionen eigentlich für den saureren Geschmack verantwortlich sind?
Wo finden wir Wasserstoff?
Bearbeiten
Wasserstoff in seiner atomaren Form kommt gewöhnlich im Weltraum und in Sternen vor. Dort gibt es riesige Wasserstoffwolken. Doch den meisten Wasserstoffatomen im Weltraum fehlt ein Elektron, was bedeutet, dass sie Ionen sind.
Wasserstoff ist ein wichtiger Bestandteil allen Lebens auf der Erde. Er ist Bestandteil von Wassermolekülen und er ist zusammen mit Kohlenstoff in jedem organischen Molekül vorhanden. Organische Moleküle sind im Erdöl und seinen Produkten, im Erdgas und in Kunststoffen zu finden. Besonders komplexe organische Moleküle sind Fette und die Aminosäuren, die als Bestandteile von Eiweiß die Bausteine jedes Lebewesens sind.
Wasserstoff wird von der Industrie durch elektrochemische Reaktion mit Mineralien wie Magnesium und durch Elektrolyse erzeugt.
Wozu brauchen wir Wasserstoff?
BearbeitenWenn Wasserstoff (H) mit Sauerstoff (O) zu Wasser H2O verbrennt, wird Energie in Form von Wärme freigesetzt. Umgekehrt muss man dieselbe Energiemenge aufwenden, um das Wasser so zu zerlegen, damit wieder reiner Wasserstoff und reiner Sauerstoff daraus wird. Damit lässt sich wunderbar Energie speichern und aufheben.
- Erdöl besteht aus Molekülen mit vielen aneinandergehängten Kohlenstoff-Atomen (C), richtige C-C-C-C Ketten. Wenn man nun an jedes Kohlenstoff-Atom Wasserstoff-Atome dranhängt, dann kann man im Erdöl Energie speichern. Die wichtigste technische Anwendung von Wasserstoff ist die Behandlung und Verarbeitung von Erdöl und seinen Produkten – also Öl, Benzin, Diesel und Kunststoffe.
- Hängt man Wasserstoffatome (H) an ein Stickstoffatom (N) dran, bekommt man Ammoniak NH3, den man für die Herstellung von Düngemitteln benötigt.
- Wasserstoff kann auch direkt als Kraftstoff verwendet werden. In Raketen werden Sauerstoff und Wasserstoff verbrannt, damit genug Schub erzeugt wird, um in den Weltraum zu fliegen.
- In Brennstoffzellen verbinden sich Wasserstoff und Sauerstoff zu Wasser – ohne Flamme – dabei wird elektrischer Strom erzeugt.

In der Zukunft wird die Brennstoffzelle vielleicht den Motor in unseren Autos ersetzen, sodass beim Autofahren keine giftigen Abgase, sondern einfach Wasser freigesetzt wird. Statt Benzin würde man dann an der Tankstelle Wasserstoff tanken. Reiner Wasserstoff muss jedoch erst hergestellt werden, da er in der Natur in Form von Wasser gebunden vorkommt. Um Wasser mit elektrischem Strom in Wasserstoff und Sauerstoff zu trennen ist Energie nötig, die in Kraftwerken erzeugt werden muss. Der Wasserstoff kann dann stark zusammengedrückt in Flaschen und Tanks gelagert werden und als Energiespeicher dienen.

- Sterne strahlen Licht und Wärme ab, weil in ihrem Inneren Wasserstoffatome verschmolzen werden - dies nennt man Kernfusion. Dabei entsteht das Element Helium und extrem viel Energie. Die Wissenschaft forscht nach einer Möglichkeit, die Energie der Kernfusion in einer Art Kraftwerk zu nutzen. Das ist wegen der hohen Temperaturen (100 Millionen °C) nicht so einfach. Die hohen Temperaturen müssen erst einmal erzeugt und das sehr heiße Material sicher gehandhabt werden. Gelänge es, hätten wir eine Energiequelle, die keine Luftverschmutzung verursacht - jedoch würden die Wände des Reaktors stark verstrahlt werden und müssten wegen der gefährlichen Strahlung von der Umwelt ferngehalten werden, allerdings nicht so lange wie der strahlende Abfall von Atomkraftwerken. Brennstoff wäre reichlich vorhanden, schließlich ist Wasserstoff eines der häufigsten Elemente auf unserem Planeten.
- Wasserstoffgas ist leichter als Luft. Deshalb kann man Ballons damit füllen. Heute verwendet man lieber Helium, weil Wasserstoff brandgefährlich ist.
Ist er gefährlich?
BearbeitenElementarer Wasserstoff ist hoch entzündlich und wenn er mit Sauerstoff gemischt wird, kann er explodieren. Man nennt diesen Vorgang daher auch Knallgasreaktion.
-
Gasflasche
-
entzündbar
== Wolfram ==
 |
 |
Die Position von Wolfram im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus? Wie riecht es, wie schmeckt es?
Bearbeiten
Wolfram ist ein Schwermetall, das silbrig-grau oder silbrig-weiß sein kann. Wolfram in seiner reinen Form ist weich genug, um es mit einer Eisensäge durchzusägen.
Wie wurde Wolfram entdeckt?
BearbeitenGeorgius Agricola schrieb im Jahre 1546 ein Buch über die wichtigsten Erze und Mineralien wie dem Wolframerz. (Georgius Agricola gilt als einer der bedeutendsten Wissenschaftler seiner Zeit wird häufig "Vater der Geologie" genannt. Sein Geburtsname war Georg Bauer (oder Georg Pawer), aber als Bewunderer des Altertums gab er sich selbst den lateinischen Namen.)
Im Jahr 1783 wurde das Metall Wolfram erstmalig von zwei spanischen Chemikern, den de Elhujar Brüdern, hergestellt.
Woher kommt der Name?
BearbeitenAus einigen Zinnerzen konnte man im Mittelalter kein Zinn gewinnen, weil es das Mineral Wolframit enthielt. "Wolfram" bedeutet soviel wie "Dreckiger Wolf, der Zinn frisst." (Der Wortteil "-ram" steht für Ruß oder Dreck.)
Wo wird es gefunden?
BearbeitenWolfram wird in bestimmten Mineralien wie dem Wolframit gefunden ((Fe, Mn)WO4). Etwa 75% der heutigen Wolframproduktion stammt aus China. Weitere wichtige Vorkommen von Wolfram findet man in den USA, Südkorea, Bolivien, Russland und Portugal.
Welche Einsatzmöglichkeiten gibt es?
Bearbeiten
Wolfram wird als Glühfaden (Glühwendel) von Glühbirnen verwendet. Die alten Glühbirnen sind aus heutiger Sicht sehr ineffizient. Es entwickelt sich sehr viel Hitze, sodass Glühfäden aus anderen Materialien schneller durchbrennen. Wolfram wird auch in Leuchtstofflampen, Fernsehröhren und Röntgengeräten eingesetzt.
- Wusstest du, dass...
- Wolfram mit 3422 °C den höchsten Schmelzpunkt aller Metalle besitzt?
Wird Wolfram mit Kohlenstoff verbunden so entsteht Wolframcarbid (WC). Diese Verbindung ist außerordentlich hart und hitzebeständig und wird daher für Bohrspitzen und Bergbaumaschinen verwendet.
Ist es gefährlich?
BearbeitenNein, eigentlich nicht.
Aber von jedem Stoff oder Produkt können Gefahren ausgehen: Wenn elektrischer Strom durch eine Glühwendel fließt, wird das Wolfram sehr heiß und kann zu Verbrennungen führen.
Wolframstücke brennen nicht, Wolframpulver brennt.
-
entzündbar
== Zink ==
 |
 |
Die Position von Zink im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht Zink aus, schmeckt, riecht und wie fühlt Zink sich an??
Bearbeiten
Zink ist ein hartes, festes und sprödes Metall und hat eine graue Farbe.
Wie wurde Zink entdeckt?
BearbeitenZink ist schon seit der Antike bekannt, wurde aber erstmals 1746 von Andreas Marggraf isoliert. Marggraf führte vor, dass man Zink aus Kieselzinkerz durch Reduktion mit Kohle herstellen kann.
Schon Jahrhunderte zuvor wurde metallisches Zink entdeckt. Zinkerze wurden verwendet um Messing und andere Zinkverbindungen (Legierungen) herzustellen. Eine Zinklegierung wurde in alten prähistorischen Ruinen in Rumänien gefunden. Zinkerze wurden zur Heilung von Wunden und entzündeten Augen verwendet. Es wird angenommen, dass in der Antike die Römer unter der Herrschaft von Augustus die ersten Menschen waren die Messing herstellen konnten. Im 13. Jahrhundert wird der Entdecker Marco Polo zitiert, wie er die Produktion von Zinkoxid in Persien beschrieb. 1374 entdeckten Inder, dass Zink ein neues Metall war. Zu dieser Zeit waren nur sieben andere Metalle bekannt. Zinkoxid wurde in Indien im 12. bis 16. Jahrhundert produziert. Dieses Zink wurde hergestellt indem man Kieselzinkerz mit organischen Materialien wie Wolle reduziert.
Woher kommt der Name?
BearbeitenDer Name Zink kommt aus dem Deutschen für Zinke (Zacke), da flüssiges Zink zackenförmig erstarrt.
- Wusstest du, dass...
- ein menschlicher Körper etwa 2,3g Zink enthält?
- in einem im Schiffswrack aus dem Altertum Zinksalbe gefunden wurde?
Wo findet man Zink?
Bearbeiten
Zink ist in reiner Form schwer zu finden, da es sehr reaktiv ist. Es macht weniger als 1% der Erdkruste aus. Meistens findet man Zink als Verbindungen, oft als das Mineral Sphalerit oder Zinkblende.
Wofür wird Zink verwendet?
Bearbeiten
Zink hat viele Verwendungszwecke: Zink wird zu Herstellung von Münzen, Messing, Bronze verwendet. Es wird auch verwendet um Metalle vor dem Rosten zu schützen. Es wird auch in Batterien verwendet, zum Beispiel in Taschenlampen. Diese Art von Batterien wurde vom französischen Chemiker George Leclanche vor über 100 Jahren erfunden. Zinkoxid wird als Sonnenschutzmittel verwendet, um die Haut vor UV-Strahlung zu schützen, welche die Haut zerstört. Zinkoxid wird auch als weiße Farbe in Fotokopien verwendet.
Ist Zink gefährlich?
BearbeitenNein es ist nicht gefährlich, außer wenn du große Mengen zu dir nimmst. Zink wird im menschlichen Körper gebraucht zum Beispiel im Immunsystem. Zinkoxid kann als Sonnenschutzmittel verwendet werden, um deine Haut vor der Schädlichen UV Strahlung zu schützen.
-
entzündbar
-
Umwelt
== Zinn ==
 |
 |
Die Position von Zinn im Periodensystem der Elemente.
|
Die Werte.
|
Wie sieht es aus und fühlt es sich an. Wie schmeckt und riecht es?
BearbeitenZinn glänzt silberweiß, es ist sehr weich und biegbar und lässt sich mit dem Fingernagel ritzen.


Wie wurde es entdeckt?
BearbeitenIm Taurusgebirge wurde seit 3500 v. Chr. Zinnbronze und Zinn gewonnen. Bronze ist eine Legierung aus Kupfer und Zinn. Diese Legierung war wesentlich besser zu bearbeiten als reines Kupfer und zugleich wesentlich härter. Wegen dieser Bedeutung wurde ein ganzes Zeitalter, Bronzezeit ( 2200 bis 800 v. Chr.), benannt. Auf die Bronzezeit folgte die Eisenzeit.
Wo der Name herkommt
BearbeitenDas Zinnerz "Zinnstein" hat die Form von Zweigen oder Stäben. Daher könnte der Name kommen. Auch der lateinisch Name "Stannum" könnte sich von dieser Form ableiten.
- Wusstest du, dass...
- Zinn "schreit", wenn er gebogen wird?
Wo wird es gefunden?
BearbeitenZinn ist seltener als Kupfer und war im Altertum wertvoller. Eine wichtige Lagerstätte befindet sich in Cornwall. Historiker vermuten, dass die Römer wegen dieser Zinn-Erz-Lager Britannien eroberten.

Wofür wird es verwendet?
BearbeitenFür Orgelpfeifen und Glocken, für Zinnfiguren und Bronzeskulpturen, als Lötzinn und Stanniol (Weihnachtsbaum-Lametta), für Zinngeschirr, Tuben, Dosen.
Ist es gefährlich?
BearbeitenNein. (Ungefährlich, kein GHS-Piktogramm.)
== Seltene_Elemente ==
Hier sind alphabetisch alle Elemente aufgezählt, zusammen mit einer kurzen Beschreibung, die kein eigenes Kapitel erhalten haben.
Actinium
Bearbeiten

Das Wort Actinium kommt von dem griechischen Wort für Strahl ("aktis"). Es strahlt so stark, dass man im Dunkel ein blaues Leuchten sehen kann.
Die Halbwertszeit gibt an, nach welcher Zeit die Hälfte eines radioaktiven Isotops zerfallen ist. Je kürzer die Halbwertszeit, desto stärker strahlt er. langlebigste Radium-Isotop 226Ra hat eine Halbwertszeit von 1600 Jahren, das langlebigste Actinium-Isotop 227Ac hat eine Halbwertszeit von 22 Jahren. Diese Zeit ist lang genug, um kleinere Mengen des Stoffes herzustellen. Das gewonnene Actinium strahlt sehr stark. (Isotope, die nur eine Halbwertszeit von einer Sekunde besitzen, können nicht in größeren Mengen hergestellt werden.)
-
radioaktiv
Americium
Bearbeiten

Americium wird in Kernkraftwerken hergestellt. (Bisher wenige Kilogramm.) Es ist ein radioaktives und spaltbares Element.
Das langlebigste Americium-Isotop 243Am hat eine Halbwertszeit von 7370 Jahren.
-
radioaktiv
Astat
Bearbeiten

Astat wurde im Jahr 1940 von Dale Corson, Kenneth MacKenzie und Emilio Gino Segrè in der Universität von Kalifornien künstlich hergestellt. 1943 entdeckten Berta Karlik und Traude Bernert sein natürliches Vorkommen. Griechisch bedeutet ἀστατέω = „unbeständig sein“. Astat ist ein nichtmetallisches Halogen.
Astat entsteht beim radioaktiven Zerfall von Uran. Astat ist ebenfalls radioaktiv und kann in relevanten Mengen gefährlich werden. Seine Farbe wird teils als schwarz, teils als metallisch beschrieben. Astat ist das seltenste Element auf der Erde. In der gesamten Erdkruste befinden sich nach unterschiedlichen Schätzungen zwischen 0,07 und 25 Gramm Astat. Es ist deshalb so selten, weil es in wenigen Stunden zerfällt. Das macht es wertvoll für die Nuklearmedizin, unter anderem zur Behandlung bösartiger Tumore, vor allem der Schilddrüse. Astat wird bei Bedarf durch den Beschuss von Bistum mit Alphateilchen hergestellt. Schon nach wenigen Stunden ist es aus dem Körper verschwunden. Wie die anderen Halogene tritt das reine Element vermutlich ebenfalls in der zweiatomigen Molekülform At2 auf.
-
radioaktiv
Barium
Bearbeiten

Aus dem Mineral Schwerspat wurde das Element Barium (vom griechischen Wort für schwer) gewonnen. Bariumhaltige Mineralien wurden 1602 von einem italienischen Schuhmacher entdeckt. Dieser Schuhmacher mit dem Namen Vincenzo Casciarolo untersuchte neben seiner Arbeit die Natur. Er entdeckte, dass einige Steine leuchten, wenn man sie für einige Zeit in die Sonne gelegt hatte. Wasserlösliche Bariumverbindungn sind in kleinen Mengen lebenswichtig, in größeren Mengen giftig. Bariumnitrat wird für grünes Feuerwerk verwendet und Bariumcarbonat als Rattengift.
-
entzündbar
-
Achtung
Berkelium
Bearbeiten

Berkelium wird in Kernreaktoren hergestellt. Es ist ein radioaktives Element.
-
radioaktiv
Bismut
Bearbeiten

Bismut (früher auch Wismuth genannt) wurde von Paracelsus (1493-1541) und kurz darauf von Georgius Agricola (1494-1555) beschrieben. Einige Bismutverbindungen wurden und werden in der Medizin verwendet: Gegen den Erreger von Magengeschwüren, gegen Mundgeruch und als Wundpulver und Hautsalbe gegen Entzündungen, zur Blutstillung und anderem.
Mit Hilfe von Bismut kann man eine Legierung herstellen, die bei 70°C schmilzt (Woodsches Metall). Es wird in Sprinklern zum Feuerlöschen verwendet. Aus diesem Metall kann man auch einen Teelöffel herstellen, der in einer Tasse mit heißen Tee schmilzt.
-
entzündbar
Bohrium
Bearbeiten

Dieses künstliche Element wurden nach Niels Bohr benannt.
-
radioaktiv
Brom
Bearbeiten

Brom bedeutet soviel wie "Gestank" (griechisch). Brom ist ein flüssiges, oranges Nichtmetall, bei dem bei Zimmertemperatur ätzende Dämpfe aufsteigen. Im Meerwasser befinden sich erhebliche Mengen an (harmlosem) Bromsalz. Diese Salze werden als Pflanzendünger verwendet. Fotoplatten werden mit Silberbromid beschichtet.
-
akut giftig
-
ätzend
-
Umwelt
Cadmium
Bearbeiten

Das Wort Cadmium ist ein altes Wort für Zinkerz, dass in Mittelalter und Altertum teilweise verwendet wurde. Es wurde 1817 unabhängig voneinander von Friedrich Stromeyer und Carl Samuel Hermann aus unterschiedlichen Zinkerzen hergestellt. Verwendet wird es für Solarzellen, Halbleiter, für Nickel-Cadmium-Akkus und auch zum Bau von Regelstäben in Kernkraftwerken. Cadmium und Cadmiumverbindungen sind hochgiftig. Deshalb sind in der EU viele Anwendungen verboten. In Japan hatten ab 1950 Zink-Bergwerke ihr Abwasser in Flüsse geleitet, mit denen Reisfelder gewässert wurden. Die Reisbauern erkrankten. Es traten bei ihnen starke Schmerzen auf. Nierenversagen und Knochenerweichung führte häufig zum Tode. Wegen der starken Schmerzen wurde sie „Aua-Aua-Krankheit“ (Japanisch "Itai-Itai-Krankheit") genannt.
-
entzündbar
-
akut giftig
-
Umwelt
-
Gesundheitsgefahr
Californium
Bearbeiten

Californium ist ein radioaktives Element, das in Kernreaktoren entsteht.
Das Californium-Isotop 252Cf sendet beim Zerfall Neutronen aus. Diese Neutronen werden benutzt bei Krebsbehandlungen, für Materialuntersuchungen in der Industrie, bei der Suche nach Erdöl, in Kernreaktoren und für den Bau von Atombomben.
-
radioaktiv
Caesium
Bearbeiten

Caesium hat besondere Eigenschaften:
- Es ist das reaktivste Metall. Es brennt explosionsartig, wenn es mit Luft in Berührung kommt.
- Es ist das weichste Metall.
- Es ist das schwerste stabile Alkalimetall.
- Es ist eines der wenigen goldfarbenden Metalle.
- Es hat, nach Quecksilber, den zweitniedrigsten Schmelzpunkt aller Metalle.
- Es ist das "pünktlichste" ;-) Element. Caesium wird in Atomuhren eingesetzt. Die Sekunde wird mit Caesiumuhren bestimmt.
Caesium wurde 1861 von Robert Wilhelm Bunsen und Gustav Robert Kirchhoff anhand seiner blauen Spektrallinien in Quellwasser entdeckt. Sie benannten das Element nach dem lateinischen Wort für himmelblau ("caesius"). Carl Setterberg hat 1881 erstmals reines Caesium hergestellt. Caesium wird für Ionenantriebe von Raketen verwendet.
-
entzündbar
-
ätzend
Cer
Bearbeiten

Dieses Element wurde 1803 parallel von verschiedenen Wissenschaftlern entdeckt. ( Jöns Jacob Berzelius, Wilhelm von Hisinger, Martin Heinrich Klaproth). Carl Gustav Mosander hat 1825 erstmalig reines Cer hergestellt.
Das Wort Cer stammt, wie der kurz zuvor entdeckte Planet Ceres, von der römischen Göttin für Ackerbau und Fruchtbarkeit Ceres.
Cer erzeugt bei Reibung leicht Funken, die kleinere Cerkrümel entzünden können. Es wird deshalb für Feuerzeuge und auch im Film zur Herstellung eines eindrucksvollen Funkenregens eingesetzt. Eisenlegierungen, die Cer enthalten sind sehr dehnbar.
-
entzündbar
-
Achtung
Copernicium
Bearbeiten

Dieses nach Nikolaus Kopernikus benannte Element wurde künstlich hergestellt und erforscht.
-
radioaktiv
Curium
Bearbeiten

Curium ist ein künstliches Element, das in Kernreaktoren hergestellt wird. Es ist radioaktiv und spaltfähig.
Dieses Element wurde nach Pierre und Marie Curie benannt. Den beiden Wissenschaftler sind viele Erkenntnisse zum Aufbau unserer Materie zu verdanken.
-
radioaktiv
Darmstadtium
Bearbeiten

Darmstadtium ist ein künstliches Element, dass 1994 in Darmstadt hergestellt wurde.
-
radioaktiv
Dubnium
Bearbeiten

Dubnium / Db wird künstlich erzeugt, indem man Atomkerne zusammenschießt. Es gibt mehrere Möglichkeiten Dubnium herzustellen:
-
radioaktiv
Dysprosium
Bearbeiten

Dieses Element benannte man nach dem griechischen Wort für schwer zugänglich (dysprósitos). Das hat folgende Ursache: Dysprosium gehört zu den Seltenen Erden. Die Seltenen Erden reagieren chemisch sehr ähnlich. In der Natur findet man sie meistens miteinander vermischt. Es ist schwer, sie zu trennen. Der Entdecker dieses Elements, Paul-Émile Lecoq de Boisbaudran fand Dysprosium im Jahre 1886 mit Hilfe der Spektralanalyse. Aber er fing nur das Licht auf, das dieses Element aussendet, rein gewinnen konnte er es nicht. Erst 1906 gelang es Georges Urbain das Element zu gewinnen.
-
entzündbar
Einsteinium
Bearbeiten

Einsteinium entsteht in Kernkraftwerken und bei der Explosion von Wasserstoffbomben.
Dieses Element wurde nach Albert Einstein benannt, dem Entwickler der Relativitätstheorie.
-
radioaktiv
Erbium
Bearbeiten

Erbiumoxid wird, wie auch einige andere Seltene Erden, zum Färben von Glas und Keramik verwendet.
-
entzündbar
Europium
Bearbeiten

Passenderweise wird Europium als Fälschungsschutz in Euro-Banknoten verwendet. Im UV-Licht fluoresziert es. Europium wurde auch in Bildschirmen und Quecksilberdampf-Lampen eingesetzt.
-
entzündbar
Fermium
Bearbeiten

Fermium ist radioaktiv und seine Isotope besitzen eine kurze Halbwertszeit (maximal 100 Tage). Fermium wurde bei der Explosion von Atombomben, in Kernkraftwerken und im Labor erzeugt.
Aus kleinen Atomen kann man durch Hinzufügen von Teilchen (Neutronen) größere Atome herstellen. Dieser Vorgang vollzieht sich in der Natur in Sternen und vor allem bei Sternexplosionen (->Supernova). So sind aus den kleinen Wasserstoffatomen die anderen Elemente entstanden.
Im Labor kann man diesen Vorgang nachvollziehen. Bis zum Element Fermium können die Atome Neutronen aufnehmen und größer werden. Die schwereren Elemente zerfallen beim Hinzufügen von Neutronen sofort. Noch schwerere Elemente kann man nur herstellen, indem man zwei Atomkerne aufeinander schießt.
-
radioaktiv
Flerovium
Bearbeiten
Nur wenige Atome Flerovium wurden hergestellt. Es wurde nach Georgi Nikolajewitsch Fljorow benannt.
-
radioaktiv
Francium
Bearbeiten

Francium hat ein Elektron auf der Außenschale und ist deshalb ein Alkalimetall. Seine Eigenschaften kann man deshalb vorhersagen, aber kaum überprüfen, da es nur winzige Mengen dieses Elementes gibt.
-
radioaktiv
Gadolinium
Bearbeiten

Gadolinium ist ein seltenes Element. Das Mineral Lepersonnit-(Gd) enthält dieses Element. Dieses Mineral hat eine komplexe chemische Zusammensetzung: Ca(Gd,Dy)2(UO2)24(SiO4)4(CO3)8(OH)24 · 48 H2O.
-
entzündbar
Gallium
Bearbeiten

Gallium ist ein seltenes, silberweißes Metall. Pro Jahr werden ca. 100 t davon produziert. Es wird für die Produktion von Leuchtdioden und Solarzellen verwendet. Paul Émile Lecoq de Boisbaudran hat 1875 dieses Element erstmalig hergestellt. Bei der Namensgebung schlug er zwei Fliegen mit einer Klappe: er benannte den Stoff sowohl nach seinem Land wie auch nach sich selbst: sowohl "Frankreich" (Gallien) als auch "Lecoq" (Hahn) heißen auf Latein "Gallus".
-
ätzend
-
Achtung
Germanium
Bearbeiten

Das Halbmetall Germanium wird für den Bau von Transistoren verwendet. 1886 stellte der deutsche Chemiker Clemens Winkler Germanium an der Bergakademie in Freiberg her. Er benannte es nach dem lateinischen Namen seines Heimatlandes. Achtung: Germaniumpulver brennt.
-
entzündbar
Hafnium
Bearbeiten

Hafnium verbrennt mit sehr hellem Licht und wird in speziellen Blitzlampen verwendet. Hafniumelektroden werden zum Schweißen verwendet. Einige Hafniumverbindungen sind sehr hart.
Hafnium wird in größeren Mengen in Steuerstäben der Kernreaktoren für Atom-U-Boote verwendet.
-
entzündbar
Hassium
Bearbeiten

Hassium ist ein künstlich hergestelltes Element.
-
radioaktiv
Holmium
Bearbeiten

Holmium wird für Hochleistungsmagnete, in Lasern und für Steuerstäbe in Brutreaktoren verwendet.
-
entzündbar
Indium
Bearbeiten

Indium sendet Licht mit einer blauen, indigofarbenen Spektrallinie aus. Es wurde 1863 von Ferdinand Reich und Theodor Richter entdeckt. Da wenig Indiumlagerstätten bekannt sind und viel Indium verbraucht wird, ist es das Metall, das möglicherweise als erstes nicht mehr in ausreichender Menge vorhanden sein wird. Es wird in Flugzeugen, Kernkraftwerken und Transistoren eingesetzt. Das Metall brennt nicht, das Pulver ist brennbar. Indium kann bei Embryos Wachstumsstörungen hervorrufen.
-
entzündbar
-
Achtung
Iridium
Bearbeiten

Iridium ist schwer und befindet sich deshalb im Erdkern und in einigen Meteoriten. Am Ende der Kreidezeit sind die Dinosaurier und viele andere Lebewesen ausgestorben. Die Ablagerungen der Sedimentschicht, die das Ende der Kreidezeit markiert, enthält viel Iridium. Ein Hinweis auf einen gewaltigen Meteoriteneinschlag. Der Einschlagskrater befindet sich in Mexiko.
Iridium hat seinen Namen vom griechischen Wort für Regenbogen (Iris). Es wird in Legierungen verwendet, die besonders hart sein müssen, wie beispielsweise die Kugel vom Kugelschreiber. Es wird auch für Zündkerzen, Schmuck, als Katalysator und für UV-Beschichtungen von Sonnenbrillen verwendet.
-
entzündbar
-
Achtung
Krypton
Bearbeiten

Krypton (Ordnungszahl 26) gehört zu den seltensten Elementen und konnte nur unter großem Aufwand in winzigen Mengen gewonnen werden. Die Entdecker Ramsay und Travers nannten es daher nach dem griechischen Wort kryptós, was „verborgen“ bedeutet. Krypton wird in Halogenlampen verwendet. Obwohl Krypton ein Edelgas ist, kann es Verbindungen eingehen (Kryptondifluorid).
Das für Superman gefährliche Kryptonit wird aus einem ausgedachten Element namens Kryptonium (Ordnungszahl 126) hergestellt.
-
Gasflasche
Lanthan
Bearbeiten

Lanthan (griech. λανθάνειν, lanthanein, „verborgen sein“) wurde 1839 vom schwedischen Chemiker Carl Gustav Mosander entdeckt. Er züchtete 1839 Kristalle aus Cernitrat. Zu seiner Überraschung bildeten sich noch eine andere Kristallform. Im Cernitrat war offensichtlich ein anderes Element versteckt. Mosander nannte es nach dem griechischen Wort für "versteckt" Lanthan. Es wird in Gläsern und in Zündsteinen verwendet.
-
entzündbar
Lawrencium
Bearbeiten

Lawrencium, benannt nach dem Erfinder des Zyclotrons wird hergestellt, indem man Atomkerne in einem Zyclotron zusammenprallen lässt.
-
radioaktiv
Livermorium
BearbeitenNur wenige Atome Livermorium wurden hergestellt. Das Element wurde nach dem Lawrence Berkeley National Laboratory (LLNL) in Kalifornien, USA benannt.
-
radioaktiv
Lutetium
Bearbeiten

Lutetium ist schwer zu gewinnen und damit teuer. Es wird nicht großtechnisch sondern meist nur für wissenschaftliche Experimente eingesetzt.
-
entzündbar
Meitnerium
Bearbeiten

Meitnerium ist ein künstlich hergestelltes Element.
-
radioaktiv
Mendelevium
Bearbeiten

Mendelevium, benannt nach Dmitri Iwanowitsch Mendelejew, wird hergestellt, indem man Atomkerne zusammenprallen lässt. Dafür wird Einsteinium253Es in einem Zyklotron mit beschleunigten Heliumkernen4He beschossen. Dabei entsteht Mendelevium256Md und ein Neutron.
-
radioaktiv
Molybdän
Bearbeiten

Molybdän wurde nach dem griechischen Namen von Blei benannt. Molybdän verträgt hohe Temperaturen und wird für Stahllegierungen verwendet. Es wird in der Erdölindustrie als Katalysator verwendet. Auch viele Lebewesen benutzen Molybdän in Bio-Katalysatoren. So stellen einige Bakterien aus Luftstickstoff Dünger her. Dazu benötigen sie Molybdän (Formel Mo). (s. Bild) Metallstücke brennen nicht, Pulver brennt dagegen leicht.
-
entzündbar
Moscovium
Bearbeiten
Nur wenige Atome Moscovium wurden hergestellt.Das Element wurde nach der Stadt Moskau benannt.
-
radioaktiv
Neodym
Bearbeiten

Neodym – der „Neue Zwilling“ – ist einer von mehreren chemisch einander ähnlichen Stoffen. Neodym kann, wie seine Zwillinge für Magnete verwendet werden. Neodympulver brennt.
-
entzündbar
-
Achtung
Neptunium
Bearbeiten

Neptunium entsteht in Kernreaktoren und kann als Brennmaterial in Kernreaktoren und auch zum Bau von Atombomben verwendet werden.
Es gibt ungefähr 20 verschiedene Neptunium-Isotope. Das langlebigste Isotop ist 237Np mit einer Halbwertszeit von 2,144 Mio. Jahren.
-
radioaktiv
Nihonium
Bearbeiten
Wenige Atome Nihonium wurden künstlich hergestellt. Nihon bedeutet auf japanisch "Japan" (Japan).
Nach der Entdeckung bekam das Element zunächst den systematischen Namen Ununtrium (chemisches Symbol Uut), eine Bildung aus lateinisch unum für ‚eins‘ und lateinisch tria für ‚drei‘, entsprechend der Ordnungszahl 113. Es wurde auch als Eka-Thallium bezeichnet, zusammengesetzt aus Sanskrit eka für ‚eins‘ und Thallium, mit Bezug auf seine Einordnung im Periodensystem ‚eine Stelle unterhalb des Thalliums‘.
-
radioaktiv
Niob
Bearbeiten

Die Elemente Niob und Tantal kommen in Erzen immer zusammen vor. Dieses Element wurde nach Niobe, der Tochter des Tantalus, benannt. Dieses Element wurde unabhängig von zwei Chemikern untersucht und unterschiedlich benannt: Charles Hatchett (1801) Heinrich Rose (1844). Für die Benennung der Elemente ist die IUPAC zuständig. Erst 1950 einigt man sich auf den Namen Niob. Niob dient als Stahllegierung und wird in Schmuck und Münzen eingesetzt. Niob brennt nicht, aber Niobpulver ist brennbar.
-
entzündbar
Nobelium
Bearbeiten

Vom Element Nobelium wurden bisher nur wenige tausend Atome hergestellt.
-
radioaktiv
Oganesson
Bearbeiten
Von dem Element Oganesson wurden nur wenige Atome hergestellt. Es wurde nach Juri Zolakowitsch Oganesjan benannt.
-
radioaktiv
Osmium
Bearbeiten

Osmium ist haltbar, hart und Hitzebeständig, aber auch recht teuer. Einige künstliche Herzklappen enthalten eine Osmiumlegierung. Früher wurde es wie auch Wolfram in Glühbirnen verwendet.
-
entzündbar
-
ätzend
-
Achtung
Palladium
Bearbeiten

Palladium erhielt seinen Namen nach dem kurz zuvor entdeckten Asteroiden Pallas, der wiederum nach der griechischen Göttin Pallas Athene benannt worden war. William Hyde Wollaston, der Namensgeber, hatte im Jahre 1803 das Element aus Platinerz extrahiert. Palladium wird als Katalysator eingesetzt. So zerstört es im Auspuff des Autos giftige Gase. Gute Weißgold-Legierungen enthalten neben Gold das Palladium. Man verwendet Weißgold für Münzen, Zahnkronen und Schmuck.
Erstaunlicherweise hat das feste Metall Palladium im Inneren Hohlräume. Wasserstoffgas kann deshalb durch heiße Palladiumbleche wie durch ein Sieb durchströmen und so von anderen Gasen getrennt werden. Legt man ein Palladiumstück in eine Druckgasflasche und füllt sie mit Wasserstoff, so saugt sich das Palladium mit dem Wasserstoff voll, wie ein Schwamm. Ein Liter Palladiumlösungen kann dreitausend Liter Wasserstoff speichern. (Tank für Wasserstoffautos.) Palladiumstücke brennen nicht, Pulver brennt dagegen leicht.
-
entzündbar
-
Achtung
Polonium
Bearbeiten

Radioaktive Elemente verwandeln sich in andere, leichtere Elemente. Dabei senden sie Strahlung aus. In einigen Bergwerken atmen Bergleute das radioaktive Gas Radon ein. Radon verwandelt sich beim Zerfall in das Metall Polonium. Polonium kann Lungenkrebs auslösen. In den Atombomben die Hiroshima und Nagasaki zerstört haben, wurde es als Neutronenquelle verwendet.
-
radioaktiv
Praseodym
Bearbeiten

"Lauchgrüner Zwilling" heißt die Übersetzung des Namens dieses Elements. Wenn man die abgebildete Praseodym-Verbindung betrachtet wird die Bezeichnung lauchgrün (griechisch: prásinos) klar. Aber was hat es mit dem Wort Zwilling (griechisch: didymos) auf sich? Im Jahre 1874 erkannte Per Teodor Cleve, dass es sich bei dem von Carl Gustav Mosander gewonnenen Stoff um zwei verschiedene Stoffe handelte, die einander fast wie Zwillinge gleichen.
Praseodym wird zum Bau von starken Magneten verwendet. Praseodympulver brennt.
-
entzündbar
Promethium
Bearbeiten

Promethium entsteht durch den radioaktiven Zerfall anderer Elemente wie Uran. Auf der ganzen Erde gibt es, fein verteilt, ca. 570g Promethium. (Die Menge wurde nicht etwa gefunden, sondern lediglich rechnerisch bestimmt.) In Kernkraftwerken wurde in den letzten Jahrzehnten soviel Promethium hergestellt, dass man chemische Experimente damit durchführen konnte. Promethium ist ein silbriges Schwermetall, das ähnlich reagiert wie Neodym.
Einige Erbauer der Atombombe sahen sich selber in der Rolle des Prometheus: Sie brachten der Menschheit das nukleare Feuer. (Nachzulesen bei Richard P. Feynman.)
Die Entdecker dieses Elementes hatten dagegen eine andere Intention: Sie benannten das Element als Warnung vor dem nuklearen Wettrüsten nach Prometheus.
-
radioaktiv
Protacinium
Bearbeiten

Im Mineral Uranit zerfällt das Element Uran und es entsteht kurzzeitig das Element Protacinium (234mPa) das rasch (Halbwertszeit: 1,17 Minuten) in Actinium zerfällt. Dieses Isotop wurde wurde 1913 von Kasimir Fajans und Oswald Helmuth Göhring entdeckt. Ein langlebiges Isotop des Elements Protacinium (231Pa) wurde 1918 von Otto Hahn und Lise Meitner entdeckt. (Halbwertszeit: 32.760 Jahre)
-
radioaktiv
Radium
Bearbeiten

Radium kommt vom lateinischen Wort für Strahl ("radius"). Das Element Radium zerfällt und sendet dabei Alphastrahlen (Heliumatomkerne), Betastrahlen (Elektronen) und Gammastrahlen (Röntgenlicht) aus. Alle Elemente die solche Strahlen aussenden werden als radioaktiv bezeichnet. Radium wurde zunächst als Medikament und in Kosmetika eingesetzt. Es dauerte etliche Jahre, bis die Gefährlichkeit der radioaktiven Strahlung erkannt wurde und fast dreißig Jahre, bis Radium nicht mehr dafür verwendet wurde. Radium wurde von Henri Becquerel entdeckt und von Marie und Pierre Curie genau untersucht. (Sie starben an den Folgen der Strahlung.)
-
radioaktiv
Rhenium
Bearbeiten

Rhenium, nach dem lateinischen Wort für den Fluss Rhein (rhenus), wird Legierungen zugesetzt um sie zu verbessern. Turbinenschaufeln können sich durch die hohen Kräfte verformen (Fachbegriff: "kriechen") oder sogar brechen (Fachbegriff: "ermüden"). Themoelemente werden aus einer Legierung aus Platin und Rhenium hergestellt. Mit ihnen kann man hohe Temperaturen (bis 2200°C) messen. Es wird auch für Heizdrähte und Glühlampen verwendet.
Rheniummetall brennt nicht, aber Rheniumpulver brennt.
-
entzündbar
Rhodium
Bearbeiten

In Platinerzen befinden sich häufig chemisch ähnliche Elemente. 1803 hat William Hyde Wollaston aus Platinerz Rhodium extrahiert. Es wird als Katalysator und als Beschichtung von Schmuck verwendet. Eine dünne Schicht aus Rhodium verhindert, dass Metalle schwarz anlaufen und es glänzt silbrig. Man kann Rhodium auch zur Herstellung von Spiegeln verwenden. Metallstücke brennen nicht, Pulver brennt dagegen leicht.
-
entzündbar
Roentgenium
Bearbeiten

Roentgenium ist ein künstlich hergestelltes Element. Es wurde nach Wilhelm Conrad Röntgen benannt.
-
radioaktiv
Rubidium
Bearbeiten

Alle Atome senden ein für sie typisches Licht aus. Rubidium sendet ein violett-rotes Licht aus. Anhand dieses Lichtes haben 1861 Robert Wilhelm Bunsen und Gustav Kirchhoff Rubidium entdeckt. Bunsen hat daraufhin aus 44200 l Quellwasser 9 g Rubidiumsalz extrahiert. (Das lateinische Wort für rot lautet "rubidus". Auch der Edelstein Rubin hat daher seinen Namen.) Rubidium wird für wenige Anwendungen wie beispielsweise für einige Vakuumröhren verwendet. An der Luft fängt Rubidium an zu brennen, wenn man es mit Wasser löscht gibt es eine Explosion.
-
entzündbar
-
ätzend
Ruthenium
Bearbeiten

Ruthenium wurde vom Entdecker des Elements, Karl Ernst Claus, nach dem lateinischen Namen für Russland (ruthenia) benannt. Winzige Mengen dieses Stoffes verbessern die Qualität von Stahllegierungen und schützt sie vor dem Verrosten. Ruthenium wird auch zur Herstellung von Festplatten und als Katalysator verwendet. Metallstücke brennen nicht, Pulver brennt dagegen leicht.
-
entzündbar
Rutherfordium
Bearbeiten
Rutherfordium ist ein künstlich hergestelltes Element, das eine kurze Halbwertszeit besitzt. Es wurde nach Ernest Rutherford benannt, der mit einem einfachen Atommodell einen Anstoß zur Entwicklung weiterer Atommodelle gegeben hat.
-
radioaktiv
Samarium
Bearbeiten

Samarium wird aus dem Mineral Samarskit gewonnen. Dieses Mineral wurde 1847 nach dem Bergbauingenieur benannt, der es entdeckt hatte. Elemente wurden in der Vergangenheit häufig nach griechischen und römischen Gottheiten benannt. Dieses Element war das erste, das nach einem Menschen benannt wurde.
Das Mineral Samarskit enthält Uran und wurde deshalb in beträchtlichen Mengen gefördert. Das Nebenprodukt Samarium wird in Lasern, Magneten und als Katalysator verwendet.
-
entzündbar
Scandium
Bearbeiten

Das Element Scandium wurde entdeckt, weil im Periodensystem von Mendelejew ein Element angezeigt wurde, das man bisher nicht kannte. Lars Fredrik Nilson suchte gezielt danach und fand es 1879.
Es wird in Quecksilberdampflampen verwendet.
Achtung: Scandiumpulver brennt leicht.
-
entzündbar
Seaborgium
Bearbeiten

Dieses künstlich hergestellte Element wurde nach Glenn T. Seaborg benannt. Seaborg ist es 1980 gelungen Goldatome herzustellen. Dieses Ziel verfolgten schon die Alchimisten.
-
radioaktiv
Selen
Bearbeiten

Selen ist ein Halbmetall und kommt in drei Formen (Modifikationen) vor: Es gibt silbergraues metallisches Seien, schwarzes nichtmetallisches Selen und rotes nichtmetallisches Selen. Es wurde wurde 1817 von Jöns Jakob Berzelius entdeckt. Das Wort "Selen" kommt vom griechischen Namen des Mondes "Selene". Es wird für den Bau von Halbleitern und für Belichtungsmesser verwendet. In geringen Spuren ist Selen lebenswichtig, in größeren Mengen akut giftig. Selen kann auch erhebliche Organschädigungen (Leber, Herz) hervorrufen.
-
akut giftig
-
Gesundheitsgefahr
Strontium
Bearbeiten

Ein strontiumhaltiges Mineral wurde 1790 von Adair Crawford in Strontian (Schottland) entdeckt und untersucht. Strontiumsalz wird in der Aluminiumindustrie und zu Herstellung von Feuerwerkskörpern verwendet. Teilweise ist es in entzündungshemmender Zahnpasta zu finden. Strontium wird auch in einigen Vakuumröhren benutzt. Pro Jahr werden ca. 500 000 t Strontiumsalz gefördert.
Strontiumbrände können weder mit Wasser noch mit Kohlendioxid gelöscht werden.
-
entzündbar
Tantal
Bearbeiten

Tantal reagiert kaum, es ist weitgehend chemisch inert. Tantaloxid reagiert weder mit Wasser noch mit Säuren. Man könnte im übertragenen Sinne sagen, Tantaloxid ist nicht in der Lage, seinen Durst zu löschen. In der griechischen Mythologie konnte der böse Tantalos als Strafe für seine Untaten seine Durst nicht löschen. Nach ihm wurde deshalb dieses Element benannt.
Tantalpulver brennt.
-
entzündbar
Technetium
Bearbeiten

Dieses Element wurde 1925 in Mineralien entdeckt. Technetium ist das erste (1937) künstlich hergestellte Element und erhielt seinen Namen nach dem griechischen Wort für künstlich (τεχνητός / technētós). In Kernkraftwerken bildet sich Technetium als radioaktiver Abfall. Bis heute haben sich ca. 80 t Technetium angesammelt. Einige seiner Isotope besitzen eine Halbwertszeit von ca. 200 000 Jahren. In geringen Mengen wird es in der Nuklearmedizin eingesetzt.
-
radioaktiv
Tellur
Bearbeiten

Tellur kommt vom lateinischen Wort "tellus" was Erde bedeutet. Es wurde 1782 von Franz Joseph Müller von Reichenstein hergestellt. Es wird als Zusatz zu Legierungen und das Oxid als Glas verwendet.
-
akut giftig
Tenness
Bearbeiten
Vom Element Tenness wurden nur wenige Atome hergestellt. Es wurde nach Tennessee, USA benannt.
-
radioaktiv
Terbium
Bearbeiten

Terbium wird in Magneten und zum dotieren von Halbleitern verwendet.
-
entzündbar
Thallium
Bearbeiten

Thallium wird für Linsen in Fotokopierern und Fotozellen benutzt.
Thallium ist hochgiftig. Möglicher Verlauf einer Vergiftung beim Menschen:
2.-3. Tag: Abwechselnd Durchfall und Verstopfung.
2.Woche: Haarausfall
2.-3. Woche: Sehstörungen, übermäßig starke Schmerzwahrnehmung, Herzrhythmusstörungen, Muskelschwäche (kann zum Tode führen) Nach der Vergiftung bleibt häufig eine dauerhafte Gesundheitsschädigung zurück: Gestörte Reflexe, Muskelschwund. Auch chronische Vergiftungen mit kleinen Mengen bergen eine erhebliche Gesundheitsgefahr!
Früher wurde eine Thalliumverbindung als Rattengift verwendet, da es erst verzögert wirkt und die Ratten nicht erkennen, dass die Köder vergiftet sind. (Junge Ratten müssen als "Vorkoster" etwas essen. Wenn sie erkranken, frisst keine andere Ratte davon.)
-
akut giftig
-
Gesundheitsgefahr
Thorium
Bearbeiten

Elemente können im Atomkern eine unterschiedliche Anzahl von Neutronen besitzen. Man bezeichnet sie als Isotope. Chemisch gesehen reagieren sie gleich, aber sie besitzen eine unterschiedliche Lebensdauer. (Die Halbwertszeit gibt an, wie lange es dauert, bis die Hälfte des vorhandenen Stoffes zerfallen ist.) Isotope mit einer sehr, sehr langen Halbwertszeit unterscheiden sich für den Chemiker nicht von normalen, stabilen Elementen. Man findet Erze, kann sie extrahieren und mit ihnen experimentieren.
Thorium wurde im Jahre 1829 von Jöns Jakob Berzelius entdeckt. Es ist ein radioaktives Element. Sein langlebigstes Isotop 232Th hat eine Halbwertszeit von 14.050.000.000 Jahren. Wegen der langen Halbwertszeit findet man es auch in der Erde und wegen der langen Halbwertszeit strahlt dieses Thorium-Isotop nur sehr wenig (kleine Dosisleistung).
Deshalb hat man die Gefährlichkeit von Thorium falsch eingeschätzt. Auch die Schädlichkeit der radioaktiven Strahlung wurde zunächst nicht erkannt und dann dauerte es noch etliche Jahre, bis die radioaktiven Stoffe nicht mehr in alltäglichen Waren verwendet wurden. Thorium wurde in Glühstrümpfen, Schweißelektroden, Glühelektroden verwendet. Linsen aus Thoriumglas besitzen besondere optische Eigenschaften. Thoriumdioxid wurde sogar als Röntgenkontrastmittel verwendet: Den Patienten wurde vor der Röntgenaufnahme das Kontrastmittel, das ca. 5g Thorium enthielt, in die Adern gespritzt. Viele Patienten erkrankten nach 30-35 Jahren an Krebs. (Das Thorium wird im Körper eingelagert. Es dauert 22 Jahre, bis die Hälfte des eingelagerten Thoriums den Körper verlassen hat: biologische Halbwertszeit.)
Thorium eignet sich auch für die Verwendung in Kernkraftwerken. Im Kernkraftwerk wird das Thorium-Isotop 232Th mit Neutronen 1n bestrahlt und verwandelt sich in das Thorium-Isotop 233Th. (Rechnung: 232+1=233). Dieses hochradioaktive Thorium-Isotop hat eine Halbwertszeit von 22 Minuten und zerfällt in zwei Schritten zu spaltbaren Uran. Kernkraftwerke die Thorium verwenden erzeugen viel Atommüll und erleichtern den Bau von Atombomben (Fachbegriff: Proliferation).
Es ist aber auch möglich mit Hilfe von Thorium atombombenfähiges Plutonium zu vernichten (Stichwort: MOX-Brennelement).
-
radioaktiv
Thulium
Bearbeiten

Thulium ist nach der Insel Thule benannt worden. Diese Insel wurde in der Antike weit im Norden entdeckt und später mit vielen Mythen versehen.
Thulium wird in Dosimetern zum Messen von radioaktiver Strahlung verwendet. Es findet auch in Szintillatoren und Lasern Verwendung.
-
entzündbar
-
Achtung
Xenon
Bearbeiten

Xenon kann in Lampen als Füllgas verwendet werden, um die Lebensdauer der Wolfrahmdrähte zu erhöhen, und ebenso die Lichtausbeute. Es gibt auch eine Anwendung bei Scheinwerfern, die im Gegensatz zu Glühlampen eine höhere Lichtausbeute bei geringerem Energiebedarf haben. Xenon wird in Excimerlasern verwendet.
-
Gasflasche
Ytterbium
Bearbeiten

Ytterbium wird in Spezialstahl, Lasern und Magneten verwendet. Die besten Dauermagnete enthalten Ytterbium.
-
entzündbar
-
Achtung
Yttrium
Bearbeiten

Im Jahre 1794 wurde in Schweden von Johan Gadolin in der Grube Ytterby ein Erz gefunden, aus dem Yttrium extrahiert wurde. Im Jahre 1824 gewann Friedrich Wöhler daraus das Element Yttrium. Yttrium gehört zu den Seltenen Erden (die gar nicht so selten sind). Man verwendet es für Magnete, Brennstoffzellen und Zündkerzen. Yttriumpulver kann sich in der Lunge ablagern und sie schädigen. Metallstücke brennen nicht, Pulver brennt dagegen leicht.
-
entzündbar
-
Achtung
Zirconium
Bearbeiten

Der Edelstein Zirkon kann durch Beimengungen anderer Elemente viele Farben haben: Farblos, Rot, Gelb, Grün, Blau, Braun oder Schwarz. Dieser Edelstein wird seit dem Altertum verwendet. Er kann leicht mit dem Diamanten verwechselt werden und wird von Betrügern teilweise als "echter" Diamant verkauft. Fachleute können ihn leicht unterscheiden, da der Zirkon bei Weitem nicht so hart ist wie der Diamant. Zirconium wird für Stahllegierungen und in Kernkraftwerken eingesetzt. Metallstücke brennen nicht, Pulver brennt dagegen leicht.
-
entzündbar
Hier findest Du Erklärungen von chemischen Begriffen und Links zu Erklärungsseiten:
- Aggregatzustände: fest, flüssig und gasförmig (in einigen speziellen Fällen auch superfest oder superflüssig)
- Alchemie: In der Alchemie des Mittelalters mischten sich wissenschaftliche, astrologische und magische Vorstellungen. Aus ihr entwickelte sich im Laufe der Jahrhunderte die Chemie als Wissenschaft.
- Alkalimetall: Die Elemente Lithium, Natrium, Kalium, Rubidium, Caesium und Francium werden Alkalimetalle genannt. Sie alle stehen in der ersten Gruppe der Periodensystems der Elemente. Gemeinsame Eigenschaften: Alkalimetalle sind metallisch glänzende silbrig-weiße, weiche und leichte Metalle. Sie sind alle mit einem Messer schneidbar und haben eine geringe Dichte. Lithium, Natrium und Kalium schwimmen sogar auf Wasser. Da Alkalimetalle mit Luft und Wasser sehr heftig reagieren werden sie in Paraffin oder Petroleum aufbewahrt.
- Amalgam: Eine metallische Legierung, die Quecksilber in sich hat.
- Atom: So nennt man die winzig kleinen Teilchen eines Elementes, die die chemischen Eigenschaften des Elements hervorrufen.
- Atomhülle: Äußerer Teil eines Atoms. Es enthält alle Elektronen des Atoms.
- Atomkern: Zentrum eines Atoms. Es enthält alle Protonen und Neutronen des Atoms.
- chemische Bindung: Eine Verbindung zwischen Atomen, die ein Molekül bilden.
- chemische Substanz: Ein reiner Stoff, der aus einer einzigen Art von Molekül hergestellt ist.
- Chemie: Dies ist die Wissenschaft die sich mit den Eigenschaften, den Zusammensetzungen und den Veränderungen von Stoffen beschäftigt.
- Edelgase: Die äußerste Elektronenschale ist bei den Edelgasen vollständig mit Elektronen ausgefüllt. Weil dort kein Platz mehr ist, an dem sich ein anderes Atom „andocken“ könnte, bleibt das Edelgas alleine. Ein solches Atom kann sich also kaum mit anderen Atomen verbinden und wird deshalb als etwas Besonderes angesehen. Deshalb werden sie als "edel" bezeichnet. Es gibt nur wenige bei Raumtemperatur stabile Moleküle oder Festkörper, die Edelgase enthalten. Bekannt sind wenige Verbindungen von Krypton und Xenon.
- Elektron: Ein negativ geladenes Elementarteilchen, das in allen Atomen vorkommt.
- Elektronegativität: Sie gibt an wie stark andere Atome von den Elektronen angezogen werden.
- Element: Eine Substanz, die aus einer einzigen Atomsorte besteht.
- Elementarteilchen: Elektron, Proton, Neutron sind die Bauteile, die Bauelemente eines Atoms. Man bezeichnet sie als Elementarteilchen.
- Emulsion: Eine Flüssigkeit in dem winzige Tröpfchen schwimmen. (Milch enthält Fetttröpfchen)
- Erz: Ein Mineral in seinem natürlichen Zustand. (Aus Eisenerz kann man Eisen gewinnen.)
- Flüssigkeit: Eine Masse von Teilchen, die sich berühren und frei fließen.
- Fester Stoff: Eine Masse von Teilchen, die sich berühren und gegenseitig festhalten.
- Gas: Eine Masse von Teilchen, die sich nicht berühren und frei im Raum herumfliegen.
- GHS: Ein weltweit einheitliches System der Vereinten Nationen zur Einstufung von Chemikalien sowie deren Kennzeichnung u. a. auf Verpackungen: Globally Harmonized System of Classification, Labelling and Packaging of Chemicals.
- Halbwertzeit: Die Zeit, bis sich von einem radioaktiven Element die Hälfte der Atome in ein anderes Element umgewandelt hat. Bei Uran beispielsweise dauert es 4,5 Millionen Jahre, bis die Hälfte davon unter Aussendung von Alpha-Teilchedn in Thorium umgewandelt ist. Die Hälfte der Thoriumatome zerfällt in 24 Tagen zu Proactinium.
- Halogene: Die Elemente Fluor, Chlor, Brom, Iod, Astat und Tenness werden Halogene genannt. Sie stehen in der 17. Gruppe im Periodensystem der Elemente. Es sind sehr reaktive Elemente. Gemeinsame Eigenschaften: Halogene bilden zusammen mit Metallen Salze. Zum Beispiel wenn das Metall Natrium sich mit dem Halogen Chlor verbindet: :
- Ion: Ein Ion ist ein Atom, das eine elektrische Ladung trägt. Gibt ein Atom ein Elektron ab, so ist das Ion positiv geladen, nimmt es ein Elektron auf, so ist es negativ geladen.
- Ionenbindung: Unterschiedlich geladene Ionen ziehen sich an und verbinden sich miteinander.
- Isotop: Die Atome eines jeden Elements besitzt eine bestimmte Anzahl von Elektronen und Protonen. Die Zahl der Neutronen kann unterschiedlich sein. Atome eine Elements mit einer unterschiedlichen Anzahl von Neutronen nennt man Isotope. Viele Isotope sind radioaktiv.
- Katalysator: Ein Stoff, der chemische Reaktionen auslösen kann, ohne sich selbst zu verändern. So entzündet sich ausströmendes Wasserstoffgas, wenn Platin daran gehalten wird.
- Kondensation: Gases werden beim Abkühlen zu einer Flüssigkeit.
- Korrosion: Durch eine chemische Einwirkung (z.B. Luft und Wasser) zersetzen sich Metalle, sie "verrosten".
- kovalente Bindung: Eine Bindung zwischen den Atomen durch den Austausch von Elektronen gebildet wird.
- Legierung: Eine Substanz, die aus einer Mischung von zwei oder mehr Metallen besteht.
- Lösung: Ein gleichmäßiges Gemisch aus Feststoffen, Flüssigkeiten oder Gasen.
- Metall: Metalle sind Elemente. Sie glänzen silbrig oder golden, leiten den elektrischen Strom und sind biegbar. Beispiele sind Eisen, Silber, Gold.
- Mischung: Mischungen bestehen aus zwei oder mehr verschiedenen Stoffen. Die einzelnen Stoffe behalten dabei ihre Eigenschaften. Ein Beispiel dafür ist Salz und Pfeffer.
- Molekül: Ein Teilchen dass aus zwei oder mehr Atomen besteht, die chemisch miteinander verbunden sind.
- Neutronen: Ein ungeladenes Elementarteilchen, das in allen Atomen vorkommt.
- Nukleus: Atomkern
- Orbital: Bereich in der Atomhülle, in der sich die Elektronen aufhalten.
- Oxid: Eine Verbindung, die Sauerstoff und wenigstens ein weiteres Element enthält.
- Proton: Ein positiv geladenes Elementarteilchen, dass in allen Atomen vorkommt.
- Quantenmechanik: Kleine Objekte, wie Atome oder Moleküle, besitzen Eigenschaften, die wir nicht aus dem Alltag kennen. Begriffe wie Ort, Zeit, Energie besitzen hier eine uns nicht geläufige Bedeutung.
- Quasifest / Quasikristallin: große Bereiche einer Flüsigkeit gehen in ein Kristallgitter, das aber immer nur sehr kurz existiert und dessen Grenzen sich immer wieder verschieben, sodass mach diese Bereiche weder sehen noch fühlen kann. Wenn Wasser eine Temperatur zwischen 0°C und 4°C hat, lassen sich diese Bereiche nachweisen, aber nicht mit bloßem Auge beobachten, da sie nur auf molekularer Ebene existieren.
- radioaktiv: Der Atomkern vom Element Radium ist instabil und zerfällt im Laufe der Zeit. Das Radium wandelt sich dabei in ein anderes Element um uns sendet radioaktive Strahlung aus.
- radioaktive Substanz: Nicht nur Radium sondern viele Elemente bzw. Isotope besitzen einen instabilen Atomkern.
- radioaktive Strahlung: Teilchen, die eine radioaktive Substanz aussendet. Werden beispielsweise Elektronen, die im Atomkern entstehen, ausgesendet spricht man von Beta-Teilchen. Dabei verwandelt sich die Substanz in ein anderes Element. (Es dauert eine gewisse Zeit, bis sich die Substanz weitgehend umgewandelt hat.)
- schmelzen: Die Umwandlung eines festen Stoffes zu einer Flüssigkeit.
- Spin: Der Ausdruck stammt von der sich drehenden Spindel beim Garnspinnen. Hier bezeichnet man die Drehung eines Elementarteilchens.
- Sublimation: Die Umwandlung eines festen Stoffes zu einem Gas.
- subatomaren Teilchen: Teilchen, die kleiner als ein Atom sind. s. Elementarteilchen
- Verbindung: Ein Stoff, der aus mindestens zwei unterschiedlichen Elementen besteht.
- Valenzelektronen: Elektronen, die sich auf der äußersten Schale befinden. Sie können bei chemischen Reaktionen zu einem anderen Atom wandern.
- Verdampfen: Die Umwandlung einer Flüssigkeit zu einem Gas.
© Copyright 2006–2024, Wikimedia Foundation Inc. and contributing authors, all rights reserved. Permission is granted to copy, distribute and/or modify this document under the terms of the GNU Free Document License, version 1.2. A copy of this is included in the appendix entitled “GNU Free Document License”.
If you wish to be involved with editing the content of this book, please visit the following internet web address: http://de.wikibooks.org/wiki/ Wikijunior_Die_Elemente
Oben siehst du das Original-Copyright der englischen Ausgabe.
Lizenzbestimmungen
BearbeitenVersion 1.2, November 2002
Copyright (C) 2000,2001,2002 Free Software Foundation, Inc.
51 Franklin St, Fifth Floor, Boston, MA 02110-1301 USA
Everyone is permitted to copy and distribute verbatim copies
of this license document, but changing it is not allowed.
0. PREAMBLE
The purpose of this License is to make a manual, textbook, or other functional and useful document "free" in the sense of freedom: to assure everyone the effective freedom to copy and redistribute it, with or without modifying it, either commercially or noncommercially. Secondarily, this License preserves for the author and publisher a way to get credit for their work, while not being considered responsible for modifications made by others.
This License is a kind of "copyleft", which means that derivative works of the document must themselves be free in the same sense. It complements the GNU General Public License, which is a copyleft license designed for free software.
We have designed this License in order to use it for manuals for free software, because free software needs free documentation: a free program should come with manuals providing the same freedoms that the software does. But this License is not limited to software manuals; it can be used for any textual work, regardless of subject matter or whether it is published as a printed book. We recommend this License principally for works whose purpose is instruction or reference.
1. APPLICABILITY AND DEFINITIONS
This License applies to any manual or other work, in any medium, that contains a notice placed by the copyright holder saying it can be distributed under the terms of this License. Such a notice grants a world-wide, royalty-free license, unlimited in duration, to use that work under the conditions stated herein. The "Document", below, refers to any such manual or work. Any member of the public is a licensee, and is addressed as "you". You accept the license if you copy, modify or distribute the work in a way requiring permission under copyright law.
A "Modified Version" of the Document means any work containing the Document or a portion of it, either copied verbatim, or with modifications and/or translated into another language.
A "Secondary Section" is a named appendix or a front-matter section of the Document that deals exclusively with the relationship of the publishers or authors of the Document to the Document's overall subject (or to related matters) and contains nothing that could fall directly within that overall subject. (Thus, if the Document is in part a textbook of mathematics, a Secondary Section may not explain any mathematics.) The relationship could be a matter of historical connection with the subject or with related matters, or of legal, commercial, philosophical, ethical or political position regarding them.
The "Invariant Sections" are certain Secondary Sections whose titles are designated, as being those of Invariant Sections, in the notice that says that the Document is released under this License. If a section does not fit the above definition of Secondary then it is not allowed to be designated as Invariant. The Document may contain zero Invariant Sections. If the Document does not identify any Invariant Sections then there are none.
The "Cover Texts" are certain short passages of text that are listed, as Front-Cover Texts or Back-Cover Texts, in the notice that says that the Document is released under this License. A Front-Cover Text may be at most 5 words, and a Back-Cover Text may be at most 25 words.
A "Transparent" copy of the Document means a machine-readable copy, represented in a format whose specification is available to the general public, that is suitable for revising the document straightforwardly with generic text editors or (for images composed of pixels) generic paint programs or (for drawings) some widely available drawing editor, and that is suitable for input to text formatters or for automatic translation to a variety of formats suitable for input to text formatters. A copy made in an otherwise Transparent file format whose markup, or absence of markup, has been arranged to thwart or discourage subsequent modification by readers is not Transparent. An image format is not Transparent if used for any substantial amount of text. A copy that is not "Transparent" is called "Opaque".
Examples of suitable formats for Transparent copies include plain ASCII without markup, Texinfo input format, LaTeX input format, SGML or XML using a publicly available DTD, and standard-conforming simple HTML, PostScript or PDF designed for human modification. Examples of transparent image formats include PNG, XCF and JPG. Opaque formats include proprietary formats that can be read and edited only by proprietary word processors, SGML or XML for which the DTD and/or processing tools are not generally available, and the machine-generated HTML, PostScript or PDF produced by some word processors for output purposes only.
The "Title Page" means, for a printed book, the title page itself, plus such following pages as are needed to hold, legibly, the material this License requires to appear in the title page. For works in formats which do not have any title page as such, "Title Page" means the text near the most prominent appearance of the work's title, preceding the beginning of the body of the text.
A section "Entitled XYZ" means a named subunit of the Document whose title either is precisely XYZ or contains XYZ in parentheses following text that translates XYZ in another language. (Here XYZ stands for a specific section name mentioned below, such as "Acknowledgements", "Dedications", "Endorsements", or "History".) To "Preserve the Title" of such a section when you modify the Document means that it remains a section "Entitled XYZ" according to this definition.
The Document may include Warranty Disclaimers next to the notice which states that this License applies to the Document. These Warranty Disclaimers are considered to be included by reference in this License, but only as regards disclaiming warranties: any other implication that these Warranty Disclaimers may have is void and has no effect on the meaning of this License.
2. VERBATIM COPYING
You may copy and distribute the Document in any medium, either commercially or noncommercially, provided that this License, the copyright notices, and the license notice saying this License applies to the Document are reproduced in all copies, and that you add no other conditions whatsoever to those of this License. You may not use technical measures to obstruct or control the reading or further copying of the copies you make or distribute. However, you may accept compensation in exchange for copies. If you distribute a large enough number of copies you must also follow the conditions in section 3.
You may also lend copies, under the same conditions stated above, and you may publicly display copies.
3. COPYING IN QUANTITY
If you publish printed copies (or copies in media that commonly have printed covers) of the Document, numbering more than 100, and the Document's license notice requires Cover Texts, you must enclose the copies in covers that carry, clearly and legibly, all these Cover Texts: Front-Cover Texts on the front cover, and Back-Cover Texts on the back cover. Both covers must also clearly and legibly identify you as the publisher of these copies. The front cover must present the full title with all words of the title equally prominent and visible. You may add other material on the covers in addition. Copying with changes limited to the covers, as long as they preserve the title of the Document and satisfy these conditions, can be treated as verbatim copying in other respects.
If the required texts for either cover are too voluminous to fit legibly, you should put the first ones listed (as many as fit reasonably) on the actual cover, and continue the rest onto adjacent pages.
If you publish or distribute Opaque copies of the Document numbering more than 100, you must either include a machine-readable Transparent copy along with each Opaque copy, or state in or with each Opaque copy a computer-network location from which the general network-using public has access to download using public-standard network protocols a complete Transparent copy of the Document, free of added material. If you use the latter option, you must take reasonably prudent steps, when you begin distribution of Opaque copies in quantity, to ensure that this Transparent copy will remain thus accessible at the stated location until at least one year after the last time you distribute an Opaque copy (directly or through your agents or retailers) of that edition to the public.
It is requested, but not required, that you contact the authors of the Document well before redistributing any large number of copies, to give them a chance to provide you with an updated version of the Document.
4. MODIFICATIONS
You may copy and distribute a Modified Version of the Document under the conditions of sections 2 and 3 above, provided that you release the Modified Version under precisely this License, with the Modified Version filling the role of the Document, thus licensing distribution and modification of the Modified Version to whoever possesses a copy of it. In addition, you must do these things in the Modified Version:
- A. Use in the Title Page (and on the covers, if any) a title distinct from that of the Document, and from those of previous versions (which should, if there were any, be listed in the History section of the Document). You may use the same title as a previous version if the original publisher of that version gives permission.
- B. List on the Title Page, as authors, one or more persons or entities responsible for authorship of the modifications in the Modified Version, together with at least five of the principal authors of the Document (all of its principal authors, if it has fewer than five), unless they release you from this requirement.
- C. State on the Title page the name of the publisher of the Modified Version, as the publisher.
- D. Preserve all the copyright notices of the Document.
- E. Add an appropriate copyright notice for your modifications adjacent to the other copyright notices.
- F. Include, immediately after the copyright notices, a license notice giving the public permission to use the Modified Version under the terms of this License, in the form shown in the Addendum below.
- G. Preserve in that license notice the full lists of Invariant Sections and required Cover Texts given in the Document's license notice.
- H. Include an unaltered copy of this License.
- I. Preserve the section Entitled "History", Preserve its Title, and add to it an item stating at least the title, year, new authors, and publisher of the Modified Version as given on the Title Page. If there is no section Entitled "History" in the Document, create one stating the title, year, authors, and publisher of the Document as given on its Title Page, then add an item describing the Modified Version as stated in the previous sentence.
- J. Preserve the network location, if any, given in the Document for public access to a Transparent copy of the Document, and likewise the network locations given in the Document for previous versions it was based on. These may be placed in the "History" section. You may omit a network location for a work that was published at least four years before the Document itself, or if the original publisher of the version it refers to gives permission.
- K. For any section Entitled "Acknowledgements" or "Dedications", Preserve the Title of the section, and preserve in the section all the substance and tone of each of the contributor acknowledgements and/or dedications given therein.
- L. Preserve all the Invariant Sections of the Document, unaltered in their text and in their titles. Section numbers or the equivalent are not considered part of the section titles.
- M. Delete any section Entitled "Endorsements". Such a section may not be included in the Modified Version.
- N. Do not retitle any existing section to be Entitled "Endorsements" or to conflict in title with any Invariant Section.
- O. Preserve any Warranty Disclaimers.
If the Modified Version includes new front-matter sections or appendices that qualify as Secondary Sections and contain no material copied from the Document, you may at your option designate some or all of these sections as invariant. To do this, add their titles to the list of Invariant Sections in the Modified Version's license notice. These titles must be distinct from any other section titles.
You may add a section Entitled "Endorsements", provided it contains nothing but endorsements of your Modified Version by various parties--for example, statements of peer review or that the text has been approved by an organization as the authoritative definition of a standard.
You may add a passage of up to five words as a Front-Cover Text, and a passage of up to 25 words as a Back-Cover Text, to the end of the list of Cover Texts in the Modified Version. Only one passage of Front-Cover Text and one of Back-Cover Text may be added by (or through arrangements made by) any one entity. If the Document already includes a cover text for the same cover, previously added by you or by arrangement made by the same entity you are acting on behalf of, you may not add another; but you may replace the old one, on explicit permission from the previous publisher that added the old one.
The author(s) and publisher(s) of the Document do not by this License give permission to use their names for publicity for or to assert or imply endorsement of any Modified Version.
5. COMBINING DOCUMENTS
You may combine the Document with other documents released under this License, under the terms defined in section 4 above for modified versions, provided that you include in the combination all of the Invariant Sections of all of the original documents, unmodified, and list them all as Invariant Sections of your combined work in its license notice, and that you preserve all their Warranty Disclaimers.
The combined work need only contain one copy of this License, and multiple identical Invariant Sections may be replaced with a single copy. If there are multiple Invariant Sections with the same name but different contents, make the title of each such section unique by adding at the end of it, in parentheses, the name of the original author or publisher of that section if known, or else a unique number. Make the same adjustment to the section titles in the list of Invariant Sections in the license notice of the combined work.
In the combination, you must combine any sections Entitled "History" in the various original documents, forming one section Entitled "History"; likewise combine any sections Entitled "Acknowledgements", and any sections Entitled "Dedications". You must delete all sections Entitled "Endorsements."
6. COLLECTIONS OF DOCUMENTS
You may make a collection consisting of the Document and other documents released under this License, and replace the individual copies of this License in the various documents with a single copy that is included in the collection, provided that you follow the rules of this License for verbatim copying of each of the documents in all other respects.
You may extract a single document from such a collection, and distribute it individually under this License, provided you insert a copy of this License into the extracted document, and follow this License in all other respects regarding verbatim copying of that document.
7. AGGREGATION WITH INDEPENDENT WORKS
A compilation of the Document or its derivatives with other separate and independent documents or works, in or on a volume of a storage or distribution medium, is called an "aggregate" if the copyright resulting from the compilation is not used to limit the legal rights of the compilation's users beyond what the individual works permit. When the Document is included in an aggregate, this License does not apply to the other works in the aggregate which are not themselves derivative works of the Document.
If the Cover Text requirement of section 3 is applicable to these copies of the Document, then if the Document is less than one half of the entire aggregate, the Document's Cover Texts may be placed on covers that bracket the Document within the aggregate, or the electronic equivalent of covers if the Document is in electronic form. Otherwise they must appear on printed covers that bracket the whole aggregate.
8. TRANSLATION
Translation is considered a kind of modification, so you may distribute translations of the Document under the terms of section 4. Replacing Invariant Sections with translations requires special permission from their copyright holders, but you may include translations of some or all Invariant Sections in addition to the original versions of these Invariant Sections. You may include a translation of this License, and all the license notices in the Document, and any Warranty Disclaimers, provided that you also include the original English version of this License and the original versions of those notices and disclaimers. In case of a disagreement between the translation and the original version of this License or a notice or disclaimer, the original version will prevail.
If a section in the Document is Entitled "Acknowledgements", "Dedications", or "History", the requirement (section 4) to Preserve its Title (section 1) will typically require changing the actual title.
9. TERMINATION
You may not copy, modify, sublicense, or distribute the Document except as expressly provided for under this License. Any other attempt to copy, modify, sublicense or distribute the Document is void, and will automatically terminate your rights under this License. However, parties who have received copies, or rights, from you under this License will not have their licenses terminated so long as such parties remain in full compliance.
10. FUTURE REVISIONS OF THIS LICENSE
The Free Software Foundation may publish new, revised versions of the GNU Free Documentation License from time to time. Such new versions will be similar in spirit to the present version, but may differ in detail to address new problems or concerns. See http://www.gnu.org/copyleft/.
Each version of the License is given a distinguishing version number. If the Document specifies that a particular numbered version of this License "or any later version" applies to it, you have the option of following the terms and conditions either of that specified version or of any later version that has been published (not as a draft) by the Free Software Foundation. If the Document does not specify a version number of this License, you may choose any version ever published (not as a draft) by the Free Software Foundation.