Innere Medizin kk: arvc
Zurück zur Übersicht
Das Wichtigste
Bearbeiten- Die ARVC ( Arrhythmogene Rechtsventrikuläre Kardiomyopathie ) ist eine seltene aber wichtige Muskelerkrankung vorwiegend des rechten Herzens, die nicht selten mit gefährlichen Rhythmusstörungen einhergeht.
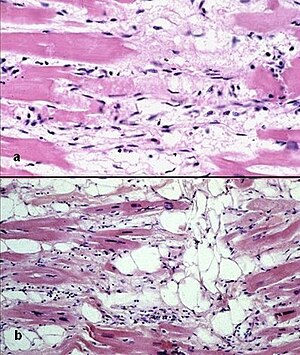
- Muskelzellen sterben teilweise ab und werden durch Fettgewebe ersetzt.
- Dadurch kommt es zu Vernarbungen und fibrolipomatösen Veränderungen der Ventrikelwände und des Ventrikrlseptums.
- 30-80% der Erkrankungen gehen auf eine genetische Verändrrung zurück.
- Meist wird die ARVC autosomal-dominant vererbt.
- Allerdings erfolgt dies mit unvollständiger Penetranz und unterschiedlicher klinischer Ausprägung.
- Unerkannt kann die ARVC die Ursache eines plötzlichen Herztodes auch bei jungen Menschen sein.
- Sie wird durch Extrasystolen in Form von Synkopen oder Palpitationen oder als Rechtsherzinsuffizienz symptomatisch.
- Bewiesen wird sie durch das Cardio MRT, das Echo, das EKG und die genetische Untersuchung.
- Behandelt wird sie durch medikamentöse Maßnahmen, Implantation eines ICD und die Vermeidung von Extremsport.
Krankheitsnummer ICD Klassifikation
BearbeitenICD10-Code: I42.80
Definition
BearbeitenBei der ARVC ist die Muskulatur der rechten Herzkammer verändert. Die Muskelzellen sterben teilweise ab und werden durch Fettgewebe ersetzt. Als Folge dünnt der Herzmuskel aus und die rechte Herzkammer erweitert sich. Da hierdurch auch das elektrische Leitungssystem des Herzens beeinträchtigt wird, können Herzrhythmusstörungen entstehen, die vor allem bei körperlicher Belastung auftreten. Die Erkrankung kann auch auf die linke Herzkammer übergehen.
- englische Bezeichnung
- Arrhythmogenic right ventricular cardiomyopathy
- Abkürzungen
- ARVC/
- ARVD
Einteilungen
BearbeitenÄtiologie Ursachen
Bearbeiten30-80% der Erkrankungen gehen auf eine genetische Prädisposition zurück. In der Mehrzahl der Fälle wird ARVC autosomal-dominant vererbt mit unvollständiger Penetranz und unterschiedlicher klinischer Ausprägung.
- In 30-50% der ARVC-Patienten sind bei einer molekulargenetischen Untersuchung der desmosomalen Gene eine (oder mehrere) Mutation(en) nachweisbar.
- Es sind weitere nicht desmosomale Gene bekannt, die mit der Entstehung einer ARVC im Zusammenhang stehen.
- Davon sind die Gene für Desmin und das Transmembranprotein 43 (TMEM43) von besonderer Bedeutung.
Epidemiologie Statistik Kosten
Bearbeiten- Die Häufigkeit ist – aus bisher ungeklärten Gründen – geographisch sehr unterschiedlich.
- Während die Krankheit in den USA relativ selten auftritt (1:100.000), betrifft sie in Europa etwa einen von 10.000 Menschen ( Prävalenz 0.6 zwischen 4.4 / 1000).
- In manchen Regionen wie z.B. Norditalien oder der griechischen Insel Naxos kann sogar einer von 1.000 Menschen erkranken.
- Meist sind bereits junge Menschen betroffen, Männer häufiger als Frauen.
- Die arrhythmogene rechtsventrikuläre Kardiomyopathie tritt in circa 50 % der Fälle familiär gehäuft auf.
- Die Inzidenz der ARVC liegt in D etwa bei 1:5000 bis 1:10000
- Der Anteil der ARVC an den Patienten mit Sekundenherztod beträgt je nach Altersgruppe bis zu 20 % (11-27%) bei unter 35 jährigen.
Pathologie Pathophysiologie
BearbeitenDie arrhythmogene rechtsventrikuläre Kardiomyopathie (ARVC) ist charakterisiert durch den fortschreitenden Verlust von Herzmuskelzellen, die durch Fett- und Bindegewebszellen ersetzt werden. Die familiäre ARVC steht im Zusammenhang mit Mutationen in den Genen, die für die Desmosom Proteine ( Plakoglobin, Desmoplakin, Plakophilin-2, Desmoglein und Desmocollin in autosomal-dominante und Plakoglobin aund Desmoplakin in autosomal-rezessive Erbgang) kodieren. [1].
Aufgrund der Mutationen entwickelt sich mechanischer Stress. Er führt zu einem Absterben der Myokardzellen . Eine chronischen Inflammation und eine chronische Verletzung der Myokardzellen führt zu einer Atrophie des Myokardes, die mit fettig-fibrösen und fettigen Einlagerungen einhergeht.
Durch die regionale Atrophie vorwiegend des rechtsventrikulären Myokards und den nachfolgenden Ersatz durch Fett- und Bindegewebe kommt es neben globalen oder regionalen Funktionsstörungen zu lokaler Verzögerung der Erregungsleitung und Dispersion der Refraktärzeiten des rechten Ventrikels. Diese sind eine Grundlage für Reentry-Mechanismen und verursachen die klinisch im Vordergrund stehenden Kammertachykardien sowie in der extremen Form einen plötzlichen Herztod (SCD).
Das arrhythmogene Substrat bei ARVC entsteht durch inselförmig im Fett- und Bindegewebe überlebende Herzmuskelfasern. Hierdurch entstehen Zonen mit lokal verzögerter Erregungsleitung, die zu Reentry-Arrhythmien prädisponieren. Das häufige Auftreten ventrikulärer Tachyarrhythmien während körperlicher Belastung, Sport oder Stress-Situationen sowie ein gute therapeutische Ansprechen der Arrhythmien auf antiarrhythmische Therapieregime mit antiadrenerger Wirkung (β-Blockade) sind hinweisend für die Bedeutung des autonomen Nervensystem bei der Arrhythmogenese der ARVC. Die bei Patienten mit ARVC nachgewiesenen Störungen der adrenergen Innervation und Signaltransduktion können dabei über eine autonome Imbalanz und abnorme adrenerge Stimulation des Myokards arrhythmogen wirken.
Symptome und Klinik
Bearbeiten- Herzrhythmusstörungen wie z.B. Herzklopfen, Herzrasen, vermehrte Extrasystolie
- Bewusstseinsstörungen und Ohnmachtsanfälle;
- Krankheitszeichen einer Rechtsherzinsuffizienz
- wie z.B. blaue Lippen, gestaute Halsvenen, vergrößerte Leber und Ödeme in Armen und Beinen;
- akutes Herzversagen;
- im schlimmsten Fall kommt es zum plötzlichen Herztod, ohne dass vorher Beschwerden bemerkt wurden.
Diagnostik
BearbeitenDie klinische Diagnose der ARVC ist komplex und erfordert detaillierte Untersuchungen. Leitsymptome der ARVC sind ventrikuläre Tachyarrhythmien bei jungen Patienten mit scheinbar normalem Herzen.
Als Richtlinie gelten die sog. McKenna-Kriterien, die 1994 erstmals erarbeitet wurden und seit 2010 wesentlich erweitert und differenzierter als aktuelle Task-Force-Kriterien vorliegen.
Legt man die neuen Task-Force-Kriterien aus 2010 zugrunde, dann rechtfertigt demnach
- das Erfüllen von zwei Hauptkriterien oder
- einem Hauptkriterium und zwei Nebenkriterien
die Diagnose einer ARVC/D. Berücksichtigung finden hierbei die globale sowie regionale Funktionsanalyse des rechten Ventrikels, die Gewebecharakteristik des rechtsventrikulären Myokards, der Nachweis von Re- und Depolarisationsstörungen sowie AV-Überleitungsstörungen und Arrhythmie im EKG ebenso wie eine etwaige positive Familienanamnese.
2010 Task-Force-Kriterien
Bearbeitensicher
Bearbeiten- 2 Major oder
- 1 Major + 2 Minor
grenzwertig
Bearbeiten- 1 Major + 1 Minorkriterium oder
- 3 Minorkriterien
möglich
Bearbeiten- 1 Majorkriterium oder
- 2 Minorkriterien
Globale/segmentale Dysfunktion/Strukturelle Veränderung der rechten Herzkammer (=RV)
BearbeitenMajorkriterien
Bearbeiten- 2D-Echo
- Regionale RV- Akinesie,-Dyskinesie,-Aneurysma und eines der folgenden Kriterien (enddiastolisch):
- PLAX RVOT > 32 mm (> 19 mm/m2 KOF) KOF = Körperoberfläche
- PSAX RVOT > 36 mm (> 21 mm/m2 KOF)
- Fractional area change < 33%
- Regionale RV- Akinesie,-Dyskinesie,-Aneurysma und eines der folgenden Kriterien (enddiastolisch):
- MRT
- Regionale RV-Akinesie,-Dyskinesie oder dyssynchrone RV-Kontraktion und eines der folgenden Kriterien (enddiastolisch)
- Ratio RV-Vol/KOF > 110ml/m2 (Männer), >100 ml/m2 (Frauen)
- RVEF < 40% RVEF = Rechtsventrikulär Auswurffraktion
- Regionale RV-Akinesie,-Dyskinesie oder dyssynchrone RV-Kontraktion und eines der folgenden Kriterien (enddiastolisch)
- RV-Angiografie
- Regionale RV-Akinesie, -Dyskinesie, -Aneurysma
Minorkriterien
Bearbeiten- 2D-Echo
- Regionale RV-Akinesie oder -Dyskinesie und eines der folgenden Kriterien (enddiastolisch):
- PLAX RVOT > 29–32 mm (16–19 mm/m2 KOF)
- PSAX RVOT > 32–36 mm (18–21 mm/m2 KOF)
- Fractional area change 33–40%
- Regionale RV-Akinesie oder -Dyskinesie und eines der folgenden Kriterien (enddiastolisch):
- MRT
- Regionale RV-Akinesie,-Dyskinesie oder dyssynchrone RV-Kontraktion und eines der folgenden Kriterien (enddiastolisch)
- Ratio RV–Vol/KOF > 100ml/m2 (Männer), >90 ml/m2 (Frauen)
- RVEF > 40–45%
- Regionale RV-Akinesie,-Dyskinesie oder dyssynchrone RV-Kontraktion und eines der folgenden Kriterien (enddiastolisch)
Gewebecharakteristik des Myokards
BearbeitenMajorkriterien
Bearbeiten- verbleibender Myozytenanteil < 60% (morphometrisch), geschätzt < 50% mit fibrotischem Umbau des Myokards in > 1 Gewebeprobe, mit fettreichem Ersatz in der Myokardbiopsie
Minor
Bearbeiten- verbleibender Myozytenanteil 60–75% (morphometrisch), geschätzt 50–60% mit fibrotischem Umbau des Myokards in > 1 Gewebeprobe, mit fettreichem Ersatz in der Myokardbiopsie
Repolarisationsstörungen
BearbeitenMajorkriterien
Bearbeiten- T-Negativierung (V1, V2 und V3); Alter > 14 Jahre, kein RSB (QRS > 120 ms)
Minorkriterien
Bearbeiten- T -Negativierung (V1-V4), Alter > 14 Jahre, mit RSB
- T-Negativierung (V1 und V2) , Alter > 14 Jahre, keine RSB oder T-Negativierung in V4, V5 oder V6
Depolarisations- und AV-Überleitungsstörungen
BearbeitenMajor
Bearbeiten- Epsilonpotenzial in den rechtspräkordialen Ableitungen (V1-V3)
Minor
Bearbeiten- Spätpotenziale im Signalmittlungs-EKG bei > 1 von 3 Parametern, wenn QRS-Komplex < 110 ms
- Gefilterte QRS-Dauer (fQRS) > 114 ms
- Terminale QRS-Dauer (LAS-Dauer) > 38 ms
- RMS-Voltage der letzten 40 ms < 20 µV
- TAD (terminal activation duration) des QRS-Komplexes > 55 ms in V1, V2 oder V3, kein RSB
Arrhythmien
BearbeitenMajor
Bearbeiten- LBS-konfigurierte ventrikuläre Tachykardie (nicht anhaltende und anhaltende)
Minor
Bearbeiten- > 500 VES/h (LZ-EKG)
- Ventrikuläre Tachykardie (nicht anhaltende und anhaltende) aus dem RVOT
Familienanamnese
BearbeitenMajor
Bearbeiten- ARVC/D bei Blutsverwandten 1. Grades durch Histologie aus Autopsie oder Chirurgie gesichert
- Pathogene Mutation (assoziiert oder möglicherweise assoziiert mit ARVD/C) im Verdachtsfall
- Bestätigte ARVC/D bei Blutsverwandten 1. Grades aufgrund der vorliegenden Kriterien
Minor
Bearbeiten- Gesicherte ARVC/D (autoptisch oder anhand der vorliegenden Kriterien) bei Blutsverwandten 2. Grades
- Frühzeitiger Herztod (< 35 Jahre) durch mögliche ARVC/D bei Blutsverwandten 1. Grades
- Schilderung von ARVC/D bei Blutsverwandten 1. Grades, bei denen die vorliegenden Kriterien nicht überprüft werden können
Molekulargenetische Diagnostik
BearbeitenDie am häufigsten betroffenen Gene, die derzeit routinemäßig untersucht werden, sind DKP2, DSP, DSG2. Die klinische Sensitivität, d.h. Anteil der positiven Ergebnisse, wenn eine Krankheit vorliegt, beträgt ca. 60%.
EKG
BearbeitenTypische EKG-Befunde der ARVC sind
- Verbreiterungen des QRS-Komplexes (>110 ms),
- tiefe und breite S-Zacken (>50 ms) und
- T-Negativierungen in den rechtspräkordialen Ableitungen.
Bei ausgeprägter ARVC können zu dem niederamplitudige Potentiale am Ende des QRS-Komplexes (Epsilon-Potential) registriert werden . Häufiger sind diese durch das hochauflösende Signalmittelungs-EKG nachweisbar (Spätpotentiale). Diese EKG-Veränderungen sind nicht nur diagnostisch wegweisend, sondern auch bedeutsam in der Risikostratifikation der ARVC.
Bildgebung
BearbeitenCharakteristische Befunde bildgebender Verfahren bei ARVC sind
- regionale oder globale Kontraktionsstörungen mit fokalen Aneurysmen oder Aussackungen,
- polyzyklischen Wandkonturen sowie
- regionaler Dilatation oder
- globaler Vergrößerung des rechten Ventrikels.
Weitere strukturelle Veränderungen beinhalten
- Trabekelhypertrophie,
- regionale Wandverdünnung durch myokardiale Atrophie sowie
- den Nachweis intramyokardial gelegenen Myokardersatzes (replacement) durch Bindewebe (Fibrose) oder Fettgewebe.
Die Veränderungen des rechten Ventrikels bei ARVC unterscheiden sich damit von denen beim „Sportlerherz“, wo lediglich eine globale Vergrößerung des rechten Ventrikels, nicht jedoch Kontraktionsstörungen oder strukturelle Veränderungen vorliegen.
Bildgebende Befunde der ARVC können durch
- die Echokardiographie,
- die Magnetresonanztomographie (MRT),
- die Computertomographie (CT),
- die rechtsventrikuläre Angiographie und
- die Endomyokardbiopsie
erhoben werden
MRT
BearbeitenEine kardiale MRT sollte bei Verdacht auf eine ARVC/D als ergänzende Untersuchung angeordnet werden. Sie ermöglicht eine genauere Analyse der globalen und regionalen Kinetik, der Wanddicke und durch eine morphologische Untersuchung auch den Nachweis fettig-fibröser Degeneration. Mittels T1-gewichteten TSE-Sequenzen können fettige Degenerationen visualisiert werden. Mittels Gabe von Kontrastmittel können Areale mit später Signalanreicherung in der RV-Wand dargestellt werden, die je nach Ausmaß und Verteilungsmuster einer fibrösen Degeneration bei ARVC/D entsprechen können. 10 Moderne Diagnoseverfahren in der Kardiologie 2–2012 Editorial Der diagnostische Nachweis einer ARVC/D ist trotzdem weiterhin häufig schwierig, weil die fettig-fibröse Degeneration nicht bei allen erkrankten Patienten zu finden ist.
Echo
BearbeitenRV und RVOT Diagnostik im Echo und im TEE
BearbeitenWichtig ist eine akribische Untersuchung des RV und des RVOT sowohl im TTE als auch im TEE
- Ausgeprägte RV-Dilatation und eingeschränkte RVEF bei normaler oder nur leicht reduzierter LV Funktion
- Regionale RV- Akinesie,-Dyskinesie,-Aneurysma
- PLAX RVOT > 32 mm (> 19 mm/m2KOF) KOF = Körperoberfläche
- PSAX RVOT > 36 mm (> 21 mm/m2KOF)
- starke Trabekularisierung in der RV Spitze
- Hyperreflexibilität des Moderatorbandes
Genetische Diagnostik
BearbeitenDa zunehmend das gleichzeitige Auftreten von mehreren Mutationen in ARVC-relevanten Genen beschrieben wird, werden die Gene für die Proteine Desmoglein 2 (DSG2), Desmocollin 2 (DSC2), Plakophillin 2 (PKP2), Plakoglobin 2 (JUP), Desmoplakin (DSP), Desmin (DES) und Transmembranprotein 43 (TMEM43) parallel sequenziert. Die Dauer der gesamten Untersuchung beträgt 6-8 Wochen.
Wo kann man eine kardiogenetische Diagnostik in D machen lassen ?
Bearbeiten- 32545 Bad Oeynhausen
- Herz- und Diabeteszentrum NRW Bad Oeynhausen – Universitätsklinik der Ruhr-Universität Bochum,
- Georgstraße 11, 32545 Bad Oeynhausen
- KardioGenetik, Erich und Hanna Klessmann-Institut für kardiovaskuläre Forschung und Entwicklung
- Prof. Dr. Hendrik Milting
- Georgstraße 11, 32545 Bad Oeynhausen
- Herz- und Diabeteszentrum NRW Bad Oeynhausen – Universitätsklinik der Ruhr-Universität Bochum,
- 48149 Münster
- Universitätsklinikum Münster,
- Albert-Schweitzer-Campus 1, 48149 Münster
- Institut für Genetik von Herzerkrankungen (IfGH)
- Prof. Dr. Eric Schulze-Bahr, Dr. Jovanca Müller
- Albert-Schweitzer-Campus 1, 48149 Münster
- Universitätsklinikum Münster,
- 55218 Ingelheim
- Bioscientia,
- Konrad-Adenauer-Straße 17, 55218 Ingelheim
- Laura Ranzenberger
- Konrad-Adenauer-Straße 17, 55218 Ingelheim
- Bioscientia,
- 60438 Frankfurt
- bio.logis Zentrum für Humangenetik,
- Altenhöferallee 3, 60438 Frankfurt am Main
- Prof. Dr. med. Daniela Steinberger, Dr. Maria Korte
- Altenhöferallee 3, 60438 Frankfurt am Main
- bio.logis Zentrum für Humangenetik,
- 60596 Frankfurt
- Universitätsklinikum Frankfurt,
- Kennedyallee 104, 60596 Frankfurt am Main
- Institut für Rechtsmedizin des Klinikums der Johann Wolfgang Goethe-Universität Frankfurt am Main
- RESCUED – Gemeinschaft gegen den plötzlichen Herztod
- PD Dr. rer. nat. Silke Kauferstein
- Kennedyallee 104, 60596 Frankfurt am Main
- Universitätsklinikum Frankfurt,
- 80335 München
- MGZ Medizinisch Genetisches Zentrum München,
- Bayerstraße 3-5, 80335 München
- Prof. Dr. med. Dipl.-Chem. Elke Holinski-Feder, PD Dr. med. Angela Abicht, PD Dr. med. Isabel Diebold, Dr. rer. nat. Ulrike Schön
- Bayerstraße 3-5, 80335 München
- MGZ Medizinisch Genetisches Zentrum München,
- 82152 Planegg-Martinsried (Landkreis München)
- Zentrum für Humangenetik und Laboratoriumsdiagnostik (MVZ Martinsried),
- Lochhamer Str. 29, 82152 Planegg
- Dr. med. Hanns-Georg Klein, Dr. med. Imma Rost, Dr. rer. nat. Christoph Marschall
- Lochhamer Str. 29, 82152 Planegg
- Zentrum für Humangenetik und Laboratoriumsdiagnostik (MVZ Martinsried),
- 97078 Würzburg
- Universitätsklinikum Würzburg,
- Am Schwarzenberg 15, 97078 Würzburg
- Deutsches Zentrum für Herzinsuffizienz, Zentrum für Genetische Herz- und Gefäßerkrankungen
- Prof. Dr. Brenda Gerull
- Am Schwarzenberg 15, 97078 Würzburg
- Universitätsklinikum Würzburg,
Therapie
BearbeitenRupturen der mechanischen Zellkontakte könnten durch Überdehnung der freien rechtsventrikulären Wand bei körperlicher Belastung die Häufigkeit der ARVC bei Sportlern, die dominante Manifestation des rechten Ventrikels und die belastungsinduzierten Arrhythmien bei ARVC erklären. Daher sollte die ARVC bei sportmedizinschen Untersuchungen besonders beachtet und betroffene Patienten vom Leistungssport und systematischem Training ausgeschlossen werden
Die individuelle Therapiestrategie symptomatischer Patienten mit ARVC richtet sich nach der Arrhythmie-Charakteristik und dem Risiko des plötzlichen Herztodes und beinhaltet die antiarrhythmische Pharmakotherapie, die Katheterablation und die Implantation eines CardioverterDefibrillators (ICD).
Verlauf und Prognose
BearbeitenFälle
BearbeitenFall 1 Tod beim Fußballspielen in Italien,
Bearbeiten- https://www.sueddeutsche.de/muenchen/arvc-selbsthilfegruppe-herzerkrankung-1.4344758
- Mädchen mit 14 Jahren plötzlich verstorben, Fehldiagnose: Myokarditis
- Sehr eindrucksvoller Fallbericht
- Mädchen mit 14 Jahren plötzlich verstorben, Fehldiagnose: Myokarditis
Fall 2 Junger Mann mit Synkope und Palpitationen
BearbeitenDiagnosen
Bearbeiten- ARVC (Arrhythmogene rechtsventrikuläre Kardiomyopathie) mit
- sehr viele VES (>12000) mit höhergradigen VES (viele Bigemini und Couplets)
- Früh einfallend, subjektiv bemerkt als Präkollaps und Herzrasen (V.a. VTs)
- Kardio-MRT: geringradig eingeschränkte LVEF 45-50%, rechte Ventrikel TAPSE 22 mm, ARVC mit Fetteinlagerungen und auffällige Trabekulisierungen im RV
- Aktuell: Primärprophylaktische S-ICD-Implantation
- Kardiovaskuläre Risikofaktoren:
- Nikotinabusus
Anamnese
BearbeitenDer Patient war heute bei HA da er sich nicht wohl fühlte. Keine Dyspnoe, keine AP-Beschwerden. Der Patient selbst verspürt keinen unregelmäßigen Pulsschlag.
Körperlicher Untersuchungsbefund
BearbeitenJunger circa 30 Jahre Patient gutem Allgemeinzustand und normalem Ernährungszustand, Gewicht 65 kg bei 1,85m. Allseits orientiert, reagiert adäquat. Haut warm und trocken, Hautcolorit unauffällig, sichtbare Schleimhäute gut durchblutet. Blutdruck bei Aufnahme 141/91mmHg, Herzfrequenz 108 /min. Kopf und Hals altersentsprechend beweglich, kein Klopfschmerz, keine Meningismuszeichen, Pupillen isokor, Visus gut, Gehör unauffällig. Keine Lippenzyanose, Zunge feucht, gerade herausgestreckt, nicht belegt. Rachengebilde reizlos. Stimme und Sprache klar und intakt. Karotiden ohne Strömungsgeräusch, Jugularvenen nicht gestaut. Pulmo : Klopfschall sonor, Atemgeräusch vesikulär, Rasselgeräusche: keine auskultierbar. Cor: Herzaktion rhythmisch, Herztöne rein, kein pathologisches Geräusch auskultierbar. Abdomen nicht adipös, weich, regelrechte Darmgeräusche, kein Druckschmerz, keine Abwehrspannung, keine Resistenzen tastbar, Nierenlager beidseits klopfschmerzfrei. Wirbelsäule und Extremitäten altersentsprechend beweglich, kein Klopfschmerz, Fußpulse allseits regelrecht tastbar. Neurologischer Status o.B. Atemfrequenz: 30/Min, O2-Sättigung: 100%,
Epikrise
BearbeitenDie stationäre Aufnahme des Patienten erfolgte zur geplanten EPU und ICD Implantation bei V.a. ARVC. Im Kardio-MRT zeigte sich der V.a. ARVC mit Fetteinlagerungen und auffällige Trabekulisierungen im RV. Zur weitern Diagnostik erfolgte eine EPU. Siehe unten Im LZ-EKG sahen wir dauerhafte sehr viele, polymorphe VES mit Lown Klassifikation IV b. Deswegen führten wir eine primärprophylaktische ICD Implantation bei hochgradigem Verdacht auf ARVC durch. Ein postoperativer Perikarderguss konnte mittels Ecokardiographie ausgeschlossen werden . Ein ICD Kontrolle zeigte eine regelrechte Aggregat und Sonden-Funktion. Wir entließen den Patienten in gutem Zustand nach hause.
EKG bei Aufnahme:
BearbeitenSR, 59/Min, +1VES, P 90, PQ 152, QRS 94, Qt 422, RS Umschlag in V 3-4
EPU
BearbeitenIndikation: Synkopenabklärung Prozedur: Diagn. elektrophysiologische Untersuchung. Befund: Der Patient berichtet über intermittierende Schwindelattacken und rezidivierende Presynkopen, z.n einmaliger Synkope. Das Langzeit-EKG zeigte häufige mono-Morphe VES > 8000/ 24 Stunden. Untersuchungsablauf: Lokalanästhesie mit Xylocain 1%. Punktion der Vena femoralis dextra in Seldinger Technik, 2x 6F-Schleuse. Ein Steerable Diagnostikkatheter 10-polig wird in CS-Position und ein 4-poliger im RV positioniert. Befund in Ruhe: NSR HF 65/ min., normale Basisintervalle.
Intervale:
- CL 950 ms.
- AH: 50 ms.
- HV: 60 ms
- Retrograde VA-Blockierung bei 600 ms
- Wenkebach: 340 ms.
- AVN-ERP: 500/290 ms.
- SNRT: 1209 ms.
Procedere:
- MRT zeigt hohen Verdacht auf ARVC, nach Guidelines ist bei dem Patient eine ICD-Implantation als primärer Schutz von SCD indiziert.
Operationsbericht Bezeichnung des Eingriffs: Neuimplantation S-ICD
Indikation des Eingriffs: gehäufte VES , Va ARVC OP-Dauer: 74 Minuten DLZ: 0,72 min. FDP: 43 cGry/cm2
Implantiertes System: Art Name Hersteller Seriennummer Datum Neu / Belassen
Aggregat Emblem S-ICD Boston Scientific Zus. Sonde Subcutaneous Lead 3501 Boston Scientific
Messwerte:
Schock-Impedanz 72 Ohm
Aktuell: Komplikationslose S-ICD-Implantation: Boston Scientific Emblem S-ICD,
Operation unter Vollnarkose und Lokalanästhesie nach single-shot-Cefuroxim. Hautdesinfektion, steriles Abdecken und Hautschnitte im Bereich der mittleren axillaren Linie im Rippenbogen-Verlauf und kleiner 2 Schnitte in xiphoidaler und sternaler Region, Präparation der ICD-Tasche zwischen Musklus Serrattus und Latissimus dorsi links. Tunneln der subkutanen ICD-Sonde von der ICD-Tasche in die parasternaler Linie links. Hierbei lassen sich gute Messwerte erzielen. Hiernach Fixierung der subkutanen Sonde über den Sleeve. Konnektion des Aggregates und Versenken in die Tasche. Fixierung mit Einzelnaht und schichtweiser Wundverschluss. Unter tiefer Sedierung wurde Kammerflimmern induziert und erfolgreich detektiert und terminiert. Postoperatives Vorgehen: Kein Heparin, ASS , Röntgen-Thorax in 2 Ebenen, Nächste Abfrage in 6 Wochen
LZ-EKG Durchgehender SR als Grundrhythmus mit einer mittl. HF von 69/Min (51-112). Sehr viele VES (8748), sehr viele Couplets, viele Bigeminus Episode. Sehr viele SVES, einige als atriale Couplets. Keine Pausen >2 Sek.
LZ-EKG Durchgehender SR als Grundrhythmus mit einer mittl. HF 83/Min (63-140). Sehr viele VES >12000; einige als Couplets und Triplets. Kein SVES.
Fall 3
Bearbeiten17 jähriger asymptomatischer Sportler mit Sekundenherztod während eines Fußballspieles. Im EKG negative T Wellen bis V4 und isolierter ventrikulärer Extraschlag. Pathologisch-Makroskopisches Präparat mit Aneurysma der RV Wand anterior und posterior
Geschichte der Krankheit
BearbeitenDie arrhythmogene rechtsventrikuläre Kardiomyopathie (ARVC) ist eine vorwiegend den rechten Ventrikel betreffende Herzmuskelerkrankung, die 1978 als eigenständige Entität beschrieben und zunächst als „rechtsventrikuläre Dysplasie“ bezeichnet wurde . Seither wird die Erkrankung zunehmend häufiger als Ursache ventrikulärer Tachyarrhythmien und plötzlicher Herztodesfälle bei anscheinend herzgesunden Patienten und Sportlern erkannt.
- 1995 wurde die ARVC in die aktualisierte Klassifikation der World Health Organization (WHO) der Kardiomyopathien aufgenommen.
Experten und Krankenhäuser
BearbeitenSelbsthilfe
BearbeitenWas kann ich als Betroffener selber tun ?
BearbeitenSelbsthilfegruppen
Bearbeiten- https://www.arvc-selbsthilfe.org/
- Gute deutsche ARVC Seite von Betroffenen und ihren Angehörigen
Fragen und Anmerkungen
BearbeitenSubcutaner ICD
BearbeitenWie gut schneidet ein subcutaner ICD gegenüber einem normalen ICD in der Verhinderung von Kammerflimmern ab ?
Literatur
Bearbeiten- Traditional vs. genetic pathogenesis of arrhythmogenic right ventricular cardiomyopathy.
- Que D, Yang P, Song X, Liu L
- Europace. 2015 Dec;17(12):1770-6. Epub 2015 Apr 28.
- Que D, Yang P, Song X, Liu L
- Genetics of right ventricular cardiomyopathy.
- Sen-Chowdhry S, Syrris P, McKenna WJ
- J Cardiovasc Electrophysiol. 2005;16(8):927.
- Sen-Chowdhry S, Syrris P, McKenna WJ
Links
Bearbeiten- gute Linkliste
- https://www.arvc-selbsthilfe.org/datenbank/allgemein/
- https://www.hdz-nrw.de/kliniken-institute/zentrale-dienste/kardiogenetik/untersuchungen/kardiomyopathien/arrhythmogene-rechtsventrikulaere-kardiomyopathie-arvc.html
- https://www.cardiomyopathy.org/arrhythmogenic-right-ventricular-cardiomyopathy/intro
- https://www.mdc-berlin.de/de/research/research_teams/cardiovascular_molecular_genetics/Projects/ARVC_0
- https://www.revespcardiol.org/en-diagnostic-criteria-for-arrhythmogenic-right-articulo-S1885585712001284
- ↑ 1Traditional vs. genetic pathogenesis of arrhythmogenic right ventricular cardiomyopathy. AU Que D, Yang P, Song X, Liu L SO Europace. 2015 Dec;17(12):1770-6. Epub 2015 Apr 28.