Anorganische Chemie für Schüler/ Wasser, Lösungen und die Teilchentheorie
Stoffe bestehen aus winzigen Teilchen, die „Atome“ genannt werden
Wasser ist für den Menschen die wichtigste Verbindung überhaupt. In diesem Kapitel wirst Du vieles über Wasser und Lösungsvorgänge lernen, denn schließlich sind im Wasser fast immer Salze aufgelöst. Außerdem lernst Du die Atome kennen und auch noch mehr über Trennungen und Trennungsvorgänge - denn auch dort spielt Wasser oft eine Rolle.
Lösen von Stoffen
Versuchsbeschreibung
In zwei große Bechergläser werden jeweils warmes und kaltes Wasser gegeben. Dann wird je ein Kristall Kaliumpermanganat (ein Salz) zugefügt und etwa 60 min beobachtet. Kaliumpermanganat dient nur als kristalliner Farbstoff. Die beiden Bechergläser dürfen nicht berührt werden, es darf zu keinen Erschütterungen kommen.
Beobachtung
Im kalten Wasser verteilt sich der Farbstoff langsam, im warmen sehr schnell. Nach etwa 60 min hat sich der Farbstoff in beiden Bechergläsern gleich gut verteilt.

Schlussfolgerung
1. Lösen des Salzes
Durch das Wasser zerfällt der Salzkristall in winzig kleine Teilchen. Es ist eine Lösung entstanden. Man sagt auch, das Salz hat sich in der Lösung aufgelöst. Wasser ist dabei das Lösungsmittel für das Salz. Diese winzigen Teilchen sind sehr klein und in sehr hoher Anzahl vorhanden. Ein winziger Kristall kann davon so viele enthalten, dass die Anzahl mehr wäre als eine Milliarde mal eine Milliarde mal 100. Es dürften so ca. 100 000 000 000 000 000 000 000 sein.
2. Verteilen des Farbstoffes
Alle Atome bewegen sich und stoßen dabei auch aneinander. Diese Eigenbewegung kann man sich als ein Zittern oder Schwingen vorstellen. Sie wurde von dem schottischen Biologen Robert Brown 1827 entdeckt. Dadurch kommt es zur Verteilung der Atome in der ganzen Lösung.
deshalb funktioniert der Versuch im warmen Wasser auch so gut.
Aufgaben
- Löst sich Zucker im Tee, auch wenn man nicht umrührt?
- Wenn jemand eine Mandarine isst, riecht man das bald im ganzen Raum. Warum?
- Warum wird Wäsche mit 40°C heißem Wasser gewaschen?
- Was kann man versuchen, wenn sich ein hartnäckiger Fleck bei 40°C nicht löst?
Sieden
Dieser Versuch wird Dir sicherlich gefallen - er ist einfach und in der Erklärung faszinierend. Angeblich sind bei diesem Versuch schon Schüler durchgedreht ;-)
Versuchsbeschreibung
Man bringt Wasser in einem Becherglas zum Kochen und beobachtet es genau. Mit einem wassergefüllten Reagenzglas sollen die aufsteigenden Gasbläschen aufgefangen werden.
| Beobachtung |
Schlussfolgerung |
| 1. Becherglas beschlägt von außen | Wasser aus dem Erdgas setzt sich auf dem kalten Glas von außen ab |
| 2. Schlierenbildung | Warme und kalte Wasserschichten (=Dichteunterschiede) vermischen sich |
| 3. Kleine Gasblasen steigen auf |
gelöste Gase (Stickstoff und Sauerstoff) entweichen. Auch Gase lösen sich demzufolge in Wasser
Kaltes Wasser kann viel aufgelöstes Gas enthalten, warmes Wasser hingegen kaum. Je wärmer die Lösung, desto weniger Gas löst sich im Wasser.
|
| 4. Große Gasblasen steigen auf |
Wasser wird gasförmig und Dampfblasen steigen auf. Diese können im Gegensatz zu Beobachtung 3 nicht mit einem wassergefüllten Reagenzglas aufgefangen werden, da sie im etwas kälteren Reagenzglaswasser sofort wieder flüssig werden. |
| 5. Wassertropfen am Becherglas | Wasserdampf kühlt sich an der Glaswand ab und kondensiert. |
(und zwar im ganzen Gefäß, nicht nur an der Oberfläche, das nennt man Verdunsten)
Der Siedepunkt ist abhängig von:
a) Der Masse der Teilchen. Lässt sich über die kinetische Energie erklären (Ekin = ½ mV2)
b) Zwischenmolekularen Kräften (Vergleich H2S , H2O ,...)
c) Luftdruck, der dem „Austritt“ der Moleküle entgegenwirkt (Vergleich: Ein Bergsteiger siedet im Himalaja Tee bei 80°C, im Dampfkochtopf hingegen siedet Wasser bis 120°C). Wenn der Dampfdruck gleich dem Umgebungsdruck ist, so ist die flüssige Phase nicht mehr stabil, es kommt zum Verdampfen.
Aufgaben
- Wie gelangen gelöste Gase ins Wasser? (Mineralwasser)
- Warum blubbert kochendes Wasser?
- Kann man aus sprudelndem Mineralwasser eigentlich einen Tee kochen, der normal schmeckt?
- Welches Gas ist eigentlich in Mineralwasser aufgelöst?
- Warum trocknet eine gewischte Tafel eigentlich, sie ist doch (hoffentlich) kälter als der Siedepunkt von Wasser?
- Wie kann es in einem heißem Sommer passieren, dass die Fische in kleineren Seen sterben?
- In welchen Jahreszeiten fühlen sich Fische demzufolge am wohlsten? Begründe Deine Antwort!
Vorgänge beim Erhitzen von Wasser
Auf einer der vorherigen Seiten hast Du gelernt, dass alle Stoffe aus den winzig kleinen Teilchen, den Atomen bestehen. Natürlich gilt das nicht nur für Feststoffe, sondern auch für Flüssigkeiten und Gase. Außerdem weißt Du schon, dass diese Atome ständig zittern und dieses Zittern von der Temperatur abhängig ist.
Was passiert denn nun eigentlich mit den Atomen, wenn man gefrorenes Wasser kocht? Diese Skizze zeigt die Anordnung von Atomen in den drei Aggregatzuständen fest, flüssig, gasförmig.
Zusatzinformation
Die Temperaturgrenzen sind nur unter Standarddruck wie angegeben.

Wird der Schmelzpunkt(=Smp) überschritten, lösen sich die Teilchen vom Eisblock ab, weil sie sich zu stark bewegen. Der Feststoff schmilzt. Bei weiterer Erwärmung benötigen die Teilchen immer mehr Platz, bis sie schließlich am Siedepunkt (=Sdp) in die Gasphase übergehen, weil im Außenraum, zum Beispiel über dem Kochtopf, noch genügend Platz vorhanden ist.
Der Schmelz- und der Siedepunkt sind eine Stoffeigenschaft. Jeder Stoff hat andere Schmelz- und Siedepunkte. Man kann dadurch Stoffe erkennen und zuordnen:
| Wasser | Alkohol | Eisen | Zink | |
| Schmelzpunkt | 0°C | -117°C | 1535°C | 419°C |
| Siedepunkt | 100°C | 79°C | 2870°C | 906°C |
| Quecksilber | Helium | Wasserstoff | Sauerstoff | |
| Schmelzpunkt | -39°C | -272°C | -259°C | -219°C |
| Siedepunkt | 357°C | -269°C | -253°C | -183°C |
Anwendungen im täglichen Leben
- Dampfkochtopf
- Feuerzeuggas, wird erst beim Öffnen gasförmig
- Mikrowelle kehrt Prozess um. Teilchen werden in Schwingung versetzt, dadurch Erwärmung.
Gefahr bei Handys, da Eiweiße im Gehirn erhitzt werden.
Aufgaben
- Erkläre jede der drei Anwendungen kurz mit dem Teilchenmodell.
- Warum bricht kaltes Eis auf einem See nicht so schnell, wie Eis bei genau 0°C?
Lösen von Salzen in Wasser
Was passiert eigentlich, wenn Du Zucker oder Salz in ein Glas mit Wasser gibst. Beobachte doch mal was passiert. Einmal, wenn du rührst und nochmal ohne zu rühren.
Gesättigte Lösung
Versuchsbeschreibung
Zu 100ml Wasser wird Salz zugefügt. Löst sich alles nach dem Rühren auf, wird ein weiterer Löffel Salz hinzugefügt. Besonders schöne Kristalle erhält man mit Alaun, chemisch korrekter Name ist Kaliumaluminiumsulfat.
Beobachtung
In der Lösung löst sich die Menge von zwei Löffeln auf, der dritte bildet einen Bodenkörper. Der BodenKÖRPER ist übrigens der Teil, der sich nicht auflöst.
Schlussfolgerung
Eine Lösung ist ein homogenes Gemisch, das aus einem oder mehreren gelösten Stoffen und einem Lösungsmittel besteht. Viele Salze lösen sich in Wasser auf, aber das Lösungsmittel Wasser kann nicht unendlich viel Salz auflösen. Ist die Menge zu groß, bleibt ein Rückstand am Boden zurück. Man spricht von einer gesättigten Lösung. Lösungsmittel sind üblicherweise Flüssigkeiten. Die gelösten Stoffe können fest, flüssig oder gasförmig sein.
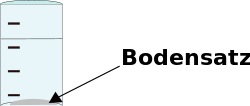
Nicht alle Salze lösen sich gut in Wasser.
übersättigte Lösung
Wenn man zu einer gesättigten Lösung weiter Salz zufügt, entsteht ein Bodenkörper. Dieser löst sich unter Umständen beim Erwärmen. Es entsteht eine übersättigte Lösung. Diese enthält mehr Salz, als sie eigentlich aufnehmen kann.
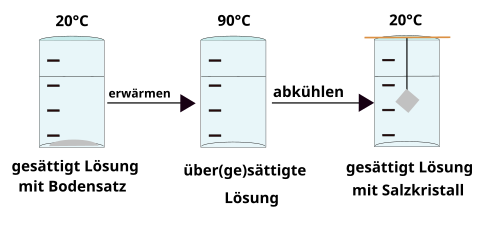
Beim Abkühlen gibt die übersättigte Lösung zuviel gelöstes Salz unter Umständen wieder ab. Wenn man einen Faden (am Besten mit einem kleinen Kristall daran) in die Lösung hängt, „wächst“ ein Kristall.
Unterkühlte Salzlösung
Nachdem Du jetzt den Schmelzpunkt und den Siedepunkt von Wasser kennen gelernt hast, stellt sich die Frage, ob Wasser sich gleichmäßig erwärmt, wenn man es erhitzt. Und was passiert, wenn man nicht reines Wasser, sondern Wasser mit gelöstem Salz kocht?
Versuchsbeschreibung
Je 6 Eiswürfel werden in einem Becherglas mit etwas Wasser benetzt. Die Temperatur wird gemessen. Das Wasser wird nun gekocht und die Temperatur alle 20s gemessen. Eine zweite Gruppen kocht die Eiswürfel, fügt aber 3 Löffel Kochsalz hinzu. Nach Versuchsende wird ein Koordinatensystem (z. B. mit Excel) erstellt.
Beobachtung
| Zeit [s] | Temperatur Wasser [°C] | Temperatur Salzwasser [°C] |
| 0 | 0 | -8 |
| 20 | ||
| 40 | ||
| 60 | ||
| ... |

Man sieht, dass sich Wasser und die Salzlösung gleichmäßig erwärmen - solange keine Eiswürfel mehr darin schwimmen - denn dann ist die genaue Messung sehr schwierig. Die Temperaturkurve von Salzwasser beginnt allerdings bei geringeren Temperaturen und erreicht ihren Sättigungspunkt bei höheren Temperaturen, als die von reinem Wasser.
Schlussfolgerung
Erklärung für die 8. Klasse
Wasser schmilzt bei 0°C und siedet bei 100°C. Gibt man Kochsalz hinzu, wird der Schmelzpunkt herabgesetzt, da sich Salzteilchen zwischen die Wasserteilchen drängeln und so die Anordnung im gefrorenen Kristall „stören“. Das Eis schmilzt, obwohl es noch nicht seinen Schmelzpunkt erreicht hat.
Beim Sieden passiert etwas Ähnliches. Die Salzteilchen bewegen sich sehr schnell und entnehmen so dem System zusätzlich Energie. man muss mehr Hitze zufügen, damit alle Wasserteilchen in die Gasphase übertreten können.
Beachte die allgemeinen Aussagen eines Diagramms
- je steiler die Gerade, desto höher die Geschwindigkeit.
- Unterbrechungen sagen etwas über den Versuchsverlauf aus. Steigt es, wie gewohnt, danach weiter, so liegt ein Messfehler vor, entsteht eine Stufe, so war vielleicht der Brenner aus. Fällt die Temperatur, so wurde vielleicht kälteres Wasser zugefügt.
Aufgaben
- Erkläre die Wirkung von Streusalz!
- Warum wird in die Scheibenwaschanlage (im Winter) Alkohol zum Seifenwasser zugefügt?
- Warum gefriert eine mit Alkohol enteiste Scheibe schneller wieder, als eine, die freigekratzt wurde?
Übung: Eigenschaften von Lösungsmitteln
Welche Stoffe lösen sich eigentlich in Wasser auf? Sind es alle Stoffe, oder unterscheiden sie sich? Außerdem gibt es noch andere Lösungsmittel außer Wasser (z. B. Benzin oder Alkohol). Dieser Versuch soll klären, ob es für das Auflösen von Stoffen eine Gesetzmäßigkeit gibt.
Versuchsbeschreibung
Nimm dir die verschiedenen Lösungsmittel und untersuche, wie viel sich von den angegebenen Feststoffen darin löst. Beachte, dass eine Trübung immer bedeutet, dass sich ein Stoff nicht aufgelöst hat. Kennzeichne dann mit den Symbolen „+“, „•“ Und „–“, wie gut sich die Feststoffe in den jeweiligen Lösungsmitteln auflösen.
Beobachtung
| Kochsalz(NaCl) | Traubenzucker(C6H12O6) | Mehl/Stärke | Kaffee | |
| Wasser | ||||
| Spiritus | ||||
| Benzin | ||||
| Aceton[1] | ||||
| Mineralsalztablette | Vitamin C | Butter/ Fett | Speiseöl | |
| Wasser | ||||
| Spiritus | ||||
| Benzin | ||||
| Aceton[2] |
Schlussfolgerung
Nicht alle Stoffe können sich in jedem Lösungsmittel auflösen.
Viele Stoffe lösen sich in Wasser oder in Benzin/ Aceton. Kein Stoff löst sich gut ein beiden Flüssigkeiten. Einige Stoffe lösen sich in gar keinem Lösungsmittel auf, wie z. B. das Mehl.
Die Ursache ist die so genannte Polarität, die die Du im nächsten Jahr noch besser kennen lernen wirst. Es gibt sogenannte polare und apolare (=unpolare) Lösungsmittel. Man unterscheidet dabei nicht nur hinsichtlich der Polarität von Lösungsmittel, sondern auch der Polarität des zu lösenden Stoffes. Wasser ist z. B. ein „polares“ Lösungsmittel. Benzin ein „nicht-polares“ (=„apolares“) Lösungsmittel.
In einem apolaren hingegen nur apolare Stoffe.
Salz ist ein polarer Stoff. Er löst sich also nur in polaren Lösungsmittel wie z. B. Wasser. Fette hingegen sind apolar und lösen sich gut in apolaren Lösungsmitteln wie Benzin, Terpentin, Verdünner oder Aceton.
Es gilt:
Stoffe, die sich nicht in Wasser lösen „hydrophob“.
Im Alkohol liegt eine Mittelstellung vor, da er weniger polar als Wasser, aber polarer als Benzin ist. In ihm lösen sich sowohl polare, als auch apolare Stoffe, aber in jeweils geringerer Menge, als im entsprechendem Lösungsmittel.
Aufgaben
- Warum gehen Fettflecken und Schmiereflecken so schlecht in der Waschmaschine aus der Kleidung?
- Welches Lösungsmittel schlägst Du vor, um Fett von der Fahrradkette zu entfernen?
- Nagellack und Edding sind nicht wasserlöslich. Wie kann man sie stattdessen entfernen?
- Welche Möglichkeiten gibt es „Hähnchen-verschmierte Finger“ zu reinigen?
- Ein Schüler hatte einen Motorschaden mit seinem Mofa. Er vermutet, dass ihm jemand Zucker in den Tank getan hat.
- a) Warum ist Zucker für den Motor gefährlich und wie wirkt er sich aus?
- b) Kann man den Zucker noch nachweisen - und wie?
- Warum schwimmen die Fettaugen in der Suppe oben?
Wasser
Wasser ist eine chemische Verbindung aus Sauerstoff und Wasserstoff mit der Formel H2O. Die Bezeichnung Wasser wird besonders für den flüssigen Aggregatzustand verwendet, im festen, also gefrorenen Zustand wird es Eis genannt, im gasförmigen Zustand Wasserdampf oder einfach nur Dampf. Die chemisch korrekteste Bezeichnung wäre Wasserstoffoxid.
Wasservorkommen der Erde
Große Teile der Erde sind vom Wasser bedeckt. Die Versorgung der Weltbevölkerung mit hygienisch unbedenklichem Trinkwasser, sowie einer ausreichenden Menge Nutzwasser, stellt dennoch eine der größten Herausforderungen der Menschheit in den nächsten Jahrzehnten dar.
Die Wasservorkommen der Erde belaufen sich auf circa 1.386 Milliarden km3, wovon allein 1.338 Milliarden km3 (96,5 %) auf das Salzwasser der Weltmeere entfallen. Nur 35 Millionen km3 (2,53 %) des irdischen Wassers liegen als Süßwasser vor. Das mit 24,4 Mill. km3 (1,77 %) meiste Süßwasser ist dabei als Eis an den Polen, Gletschern und Dauerfrostböden gebunden und somit nicht der Nutzung zugänglich.
Wasser ist die einzige Verbindung, die in allen drei Aggregatzuständen auf unserem Planeten vorkommt. Insgesamt liegen 98,2 % des Wassers in flüssiger, 1,8 % in fester und 0,001 % in gasförmiger Form vor. In seinen unterschiedlichen Formen zirkuliert es fortwährend im globalen Wasserkreislauf. Diese Anteile sind jedoch nur näherungsweise bestimmbar, wobei im Zuge der globalen Erwärmung von einem Anstieg des Wasserdampfanteils ausgegangen wird.
Während Regenwasser recht rein ist (destilliertes Wasser, welches keine gelösten Stoffe enthält), kommt es beim Kontakt mit dem Boden sofort zum Auflösen von Mineralien, die im Boden sind (v. a. die Salzgruppen Sulfate, Chloride und Carbonate, die v. a. die Elemente Natrium, Kalium, Calcium und Magnesium enthalten). Sind landwirtschaftliche Betriebe in der Nähe, so findet man oft auch Stickstoffverbindungen wie Nitrate und Nitrite im Grundwasser). Grund dafür ist der hohe Gehalt an Fäkalien, welche auf die Felder als Dünger aufgetragen werden.
Meerwasser besteht zu großen Teilen aus Natriumchlorid („Kochsalz“), welches durch Meerwasserentsalzung gewonnen werden kann.
Aufbau und Eigenschaften des Wassermoleküls
Das Wassermolekül besteht aus zwei Wasserstoffatomen und einem Sauerstoffatom. Geometrisch ist das Wassermolekül gewinkelt. Die zwei Wasserstoffatome und die zwei Elektronenpaare sind folglich in die Ecken eines gedachten Tetraeders gerichtet. Der Winkel, den die beiden O-H-Bindungen einschließen, beträgt 104,45°. Die Bindungslänge der O-H-Bindungen beträgt jeweils 95,84 Picometer.
Eigenschaften des Wassers
Die Eigenschaften des Wassers sind so besonders, dass sie es zu dem bedeutendsten Stoff der Erde machen. Bis heute werfen einige Eigenschaften des Wassers Forschern teilweise Rätsel auf:
- Wasser hat vergleichsweise hohe Schmelz- und Siedepunkte. Diese wurden als Fixpunkte für Temperaturskalen festgelegt.
- Wasser siedet unter Normalbedingungen bei 100 °C und erstarrt bei 0 °C (durch gelöste Salze kann man diese Punkte allerdings verändern).
- Wasser zeigt eine Dichteanomalie, d. h. es hat seine höchste Dichte bei 4°C, bei tieferen Temperaturen nimmt die Dichte wieder ab, deshalb schwimmt Eis.
- Wasser ist ein hervorragendes polares Lösungsmittel für viele Stoffe.
- Die Löslichkeit in Wasser ist oft stark von der Temperatur abhängig; dabei verhalten sich Feststoffe und Gase unterschiedlich. Gase lösen sich besser in kaltem Wasser, dagegen lösen sich Feststoffe bei zunehmender Temperatur meist besser in Wasser. Dazu gibt es allerdings wiederum viele Ausnahmen, wie zum Beispiel das Lithiumsulfat.
- tritt Licht von der Luft ins Wasser ein, so wird es abgelenkt (gebrochen).
- Wasser weist eine vergleichsweise große Oberflächenspannung auf, da sich die Wassermoleküle gegenseitig recht stark anziehen.
- Wasser ist im reinen Zustand geschmack- und geruchlos.
- wird Wasser aus Wasserstoff und Sauerstoff gebildet, so wird viel Energie freigesetzt.
- Wasser hat im Vergleich zu anderen Flüssigkeiten eine hohe Wärmeleitfähigkeit, aber im Vergleich mit einigen Metallen eine sehr geringe.
- Wasser kann auch als Säure oder Lauge reagieren. Solche Stoffe nennt man „amphoter“.
Bedeutungen des Wassers
Klima
Wasser beeinflusst entscheidend unser Klima und ist für die Entstehung von Wetter verantwortlich, vor allem durch seine Kapazität als Wärmespeicher. In den Ozeanen wird die einstrahlende Sonnenenergie gespeichert. Diese regional unterschiedliche Erwärmung führt wegen Verdunstung zu Konzentrationsunterschieden. Dieses Konzentrationsgefälle erzeugt globale Meeresströmungen, die sehr große Wärmemengen transportieren (z. B. Golfstrom, Humboldtstrom, äquatorialer Strom, mitsamt ihren Gegenströmungen). Ohne den Golfstrom würde in Mitteleuropa arktisches Klima herrschen.
Bei der Erwärmung verdunstet Wasser, es entsteht Verdunstungskälte. Als „trockener“ Dampf (nicht kondensierend) und als „nasser“ Dampf (kondensierend: Wolken, Nebel) enthält und transportiert es latente Wärme, die für sämtliche Wetterphänomene entscheidend verantwortlich ist (Luftfeuchtigkeit, Gewitter, Föhn).
Der aus Wolken fallende Niederschlag und der Wasserdampf bewässern die terrestrischen ??Ökotope??. Auf den Landmassen können so Gewässer oder Eismassen entstehen, die wiederum das Klima beeinflussen.
Biologie
Das Leben ist nach dem heutigen Erkenntnisstand im Wasser entstanden. Wasser wurde damit zum wichtigen Bestandteil der Zelle und zum Medium der wichtigsten biochemischer Vorgänge (Stoffwechsel) in Tier und Pflanze. Das Zellplasma von Tieren kann allein bis zu 90 Prozent Wasser enthalten (sowie Fette, Kohlenhydrate, Eiweiße, Salze u.a. Substanzen). Das Blut von Tieren und der Saft in Pflanzen enthalten auch viel Wasser. Der Bedarf eines Menschen liegt bei 2-3 l/Tag
Wassergehalt in einigen Nahrungsmitteln
| Butter 18 % | Käse 30 bis 60 % | Fleisch 60-75 % | Wassermelone 90 % |
| Brot 40 % | Joghurt, Milch 75 % | Apfel, Birne 85 % | Gurken, Tomaten 98 % |
Wasserverbrauch
Der Wasserverbrauch des Menschen ist von der Entwicklung des Landes, in dem er lebt, und vom Angebot stark unterschiedlich. Wasser wird für den Verzehr (Trinkwasser), Waschen, Kochen, Landwirtschaft, Industrie u.a. verwendet.
Der Wasserbedarf in Deutschland betrug 1991 47,9 Milliarden m3, wovon allein 29 Milliarden m3 als Kühlwasser in Kraftwerken dienten. Rund 11 Milliarden m3 wurden direkt von der Industrie genutzt, 1,6 Milliarden m3 von der Landwirtschaft. Nur 6,5 Milliarden m3 dienten der Trinkwasserversorgung.
Täglicher Verbrauch
- In Deutschland bis zu 130-300l/ Person
- In USA bis zu 600l/ Person (z. B. durch viele Golfplätze oder Städte in der Wüste, wie Las Vegas)
- In Entwicklungsländern teilweise 4l/ Person
Der durchschnittliche Trinkwasserverbrauch beträgt in Deutschland ca. 130 Liter pro Einwohner und Tag. Dieser Wert ist leicht im Sinken. So lag nach dem zweiten Weltkrieg der Verbrauch noch bei ca. 150 Liter pro Tag. An dieser Ersparnis haben v.a. effizientere Wasch- und Spülmaschinen, wassersparende Toilettenspülungen und ein umweltfreundlicheres Bewusstsein einen großen Anteil. Auch die Industrie muss heute wassersparender produzieren als noch in den Nachkriegsjahren.
Aufgaben

- Vergleiche die Zahlen des täglichen Verbrauchs. Brauchst Du wirklich soviel Wasser?
-
- a) Miss mindestens eine Woche lang den täglichen Wässerverbrauch und trage die Werte in die Tabelle ein (beachte, dass ihr unter Umständen mehr als einen Wasserzähler im Haus habt).
- b) Erstelle dann ein Koordinatensystem. Wie erklärst Du dir die Sprünge darin?
-
- a) Was sind Deiner Meinung nach die größten Wasserverschwender im Haus?
- b) Wie kann man Wasser sparen?
- Wasserverschmutzung: Informiere Dich über verschmutzte deutsche Flüsse und Gewässer. Was sind diese „Verschmutzungen“? Wie kann man Wasser reinigen?
| Tag | Zähler 1 [m3] | Zähler 2 [m3] | Verbrauch [l] |
| Mo | |||
| Di | |||
| Mi | |||
| Do | |||
| Fr | |||
| Sa | |||
| so |
Übung: Trennungen
Wir haben in einer der vorherigen Lektionen schon Gemische getrennt. Hier lernst Du weitere Methoden. Sie können auch benutzt werden, um z. B. verunreinigtes Wasser zu reinigen.
Die folgenden fettgedruckten Wörter bezeichnen Methoden, die für die davor stehenden Gemische gut geeignet sind.
Sand & Wasser Sedimentieren und dann Dekantieren
Der Ausdruck Dekantieren bezeichnet den Prozess der Abtrennung eines ungelösten Feststoffes oder einer nicht vermischten Flüssigkeit aus einer zweiten Flüssigkeit. Nach einer Ruhezeit in einem Gefäß setzt sich der Feststoff am Boden ab (wie Kakaopulver in der selbst gemachten Trinkschokolade). Dieser Vorgang heißt Sedimentieren. Die Flüssigkeit schwimmt über dem Feststoff, oder das Öl auf dem Wasser. Durch vorsichtiges Abgießen einer Schicht kann man die Stoffe trennen, sozusagen „an einer Kante trennen“ (=Dekantieren). Diese Methode funktioniert z. B. auch bei Benzin und Wasser.
Alkohol & Wasser Destillieren
Wenn zwei Stoffe unterschiedliche Siedepunkte haben, verdampft ein Stoff früher als der andere (in dem Fall würde der Alkohol zuerst verdampfen, da sein Siedepunkt bei ca. 78°C liegt)
Kieselsteine & Sand Sieben
Mit einem Sieb können Sand und Steine leicht getrennt werden.
Sand & Wasser Filtieren
Mit einem Filterpapier und einem Trichter lassen sich Sand und Wasser leicht trennen. Diese Methode funktioniert immer dann, wenn einer der beiden Stoffe größer und der andere kleiner als die Poren des Filters ist. Diese Methode ist dem Sieben sehr ähnlich, nur dass die Poren viel kleiner sind.
Eisen & Schwefel Trennung mit Magneten
Sofern sich zwei Stoffe in ihren magnetischen Eigenschaften unterscheiden, können sie leicht durch einen Magneten getrennt werden. Auf diese Weise können auch zwei Metalle getrennt werden, sofern eines davon aus Eisen, Nickel oder Cobalt besteht.
Sand & Wasser Zentrifugieren
Beim Zentrifugieren werden die unterschiedlichen Dichten der beiden Stoffe ausgenutzt. Der Stoff mit der höheren Dichte, wird stärker nach außen geschleudert (vergleiche mal mit einer Fahrt in der Berg-und-Tal-Bahn oder einem Kettenkarussell). Diese Methode funktioniert ebenso mit zwei Flüssigkeiten verschiedener Dichte oder auch nasser Wäsche in der Wäscheschleuder.
Inhaltsstoffe in Filzstiften Chromatographie
Mache mal auf ein Filterpapier Punkte in 1,5 cm Höhe mit einem schwarzen Filzstift. Stelle alles in ein mit Wasser gefülltes Becherglas (nur 1 cm). Was kannst Du sehen?
Die Erklärung hierzu ist für Deinen Wissenstand noch sehr schwierig. Es hängt mit der unterschiedlichen Polarität der im Filzstift enthaltenen Farben zusammen. Sie werden je nach Polarität bis zu einer gewissen Höhe „mitgenommen“
Zusatzinformation
Aufgaben:
- Erkläre mit Deinen Worten das Prinzip, was hinter allen Trennungsvorgängen steht.
- Erstelle eine tabellarische Übersicht (oder ein Mindmap), welches die verschiedenen Methoden wiedergibt und finde zu jeder Methode mindestens noch ein Beispiel aus dem täglichen Leben.
Übung: Trennen eines Sand/ Salz Gemisches
Versuchsbeschreibung
Mit verschiedenen Mitteln soll ein Sand/ Kochsalzgemisch getrennt werden. Die Schüler dürfen selbst entscheiden, wie sie vorgehen.
Eine Möglichkeit besteht darin, Wasser als dritten Stoff zuzufügen und das Salz darin aufzulösen. Dann wird der Sand vom Salzwasser abfiltriert. Das Wasser lässt man verdampfen. Salz bleibt übrig.
Extraktion von Erdnussöl aus Erdnüssen
Versuchsbeschreibung
Eine Packung Erdnüsse wird im Mörser mit Diethylether oder Aceton zermörsert. (Diethylether ist gründlicher, Aceton gesünder). Das freiwerdende Öl wird abgegossen und mit dem noch enthaltenen Aceton in den Abzug gestellt. Es verdampft innerhalb weniger Minuten.
Beobachtung
Es entsteht zuerst ein Brei, aus dem dann Öltropfen austreten.
Schlussfolgerung
Nüsse enthalten sehr viel Öl. Dieses wird durch das Lösungsmittel Aceton herausgelöst. Im Luftzug des Abzugs verdampft es schnell - zurück bleibt das Öl.
Zusatzinformation
Pflanzenöl, Erdnuss, Erdnussöl
Die Kläranlage
Fließschema

Mechanische Stufe
In diesem ersten Teil finden Trennungen hauptsächlich aufgrund von physikalischen Eigenschaften, wie Dichte, Größe, Masse usw. statt. Hier werden etwa 20-30% der festen (ungelösten) Schwimm- und Schwebstoffe entfernt. In der weitergehenden Abwasserreinigung und der Industriewasserwirtschaft werden unter anderem Adsorption, Filtration und andere eingesetzt.
Regenentlastung
Falls Regen- und Schmutzwasser in einem Kanal der Kläranlage zugeleitet werden (Mischsystem), muss in der Regel ein Teil des Regenwassers entweder bereits im Kanalnetz oder auf der Kläranlage über einen Regenüberlauf entlastet und/oder in einem Regenüberlaufbecken gespeichert werden, um die Kläranlage nicht zu überlasten.
Rechen
In der Rechenanlage wird das Abwasser durch einen Rechen gesäubert. Im Rechen bleiben die groben Verschmutzungen wie Fäkalstoffe, Damenbinden, Toilettenpapier, Steine, aber auch Laub und tote Ratten hängen. Diese Grobstoffe würden Pumpen der Kläranlage verstopfen. Man unterscheidet Feinrechen mit wenigen mm und Grobrechen mit mehreren cm Spaltweite.
Sandfang
Ein Sandfang ist ein Absetzbecken mit der Aufgabe, grobe, absetzbare Verunreinigungen aus dem Abwasser zu entfernen, so beispielsweise Sand, Steine, Glassplitter oder Gemüsereste. Durch Sedimentation können sich diese Stoffe absetzen.
Vorklärbecken
Ein Vorklärbecken ist nicht immer vorhanden. Das Schmutzwasser fließt sehr langsam durch das Vorklärbecken. Ungelöste Stoffe (Fäkalstoffe, Papier etc.) setzen sich ab (absetzbare Stoffe) oder schwimmen an der Oberfläche auf. Etwa 30 % der organischen Belastung kann damit entfernt werden. Es entsteht Primärschlamm, der weiter zu behandeln ist.
Biologische Stufe
In diesem Verfahrensteil werden durch Mikroorganismen die organischen Verbindungen der Abwasserinhaltsstoffe abgebaut und anorganische Stoffe teilweise durch Luftzufuhr oxidiert. Hierzu wurden zahlreiche Verfahren entwickelt.
Belebungsbecken
Im Belebungsbecken werden durch Belüften von mit Bakterienschlämmen (=Belebtschlamm) vermischtem Abwasser (gelöste) Abwasserinhaltsstoffe von den Bakterien biologisch abgebaut. Dabei werden von Bakterien und anderen Einzellern Kohlenstoffverbindungen zu Biomasse und Kohlendioxid und der Nährstoff Stickstoff durch Nitrifikation (=biologische Oxidation von Ammonium zu Nitrat unter Beisein von Sauerstoff) und Denitrifikation (=Reduktion von Nitrat zu Stickstoffgas unter Abwesenheit gelösten Sauerstoffs) abgebaut. Die überschüssige Biomasse wird als Klärschlamm bezeichnet. Durch die Zugabe von Fällmitteln kann mittels chemischer Reaktionen außerdem der Nährstoff Phosphor entfernt werden. Dies verbessert auch die Absetzeigenschaften des Belebtschlammes im Nachklärbecken.
Nachklärbecken
Das Nachklärbecken bildet eine Prozesseinheit mit dem Belebungsbecken. In ihm wird der Bakterienschlamm (=Belebtschlamm) durch Absetzen aus dem Abwasser abgetrennt. Der Schlamm wird in das Belebungsbecken zurückgeführt (Rücklaufschlamm). Der durch den Abbau der Abwasserinhaltsstoffe entstehende Biomassezuwachs wird als Überschussschlamm/Klärschlamm entsorgt, bzw. in Faultürmen unter anaeroben Bedingungen zu Faulschlamm und Biogas (=Methan und Kohlendioxid) abgebaut. Auch nach der Faulung verbleibt ein restlicher Klärschlamm. Dieser ausgefaulte Schlamm kann in der Landwirtschaft verwertet werden oder muss verbrannt werden.
Zusatz: Chemische Verfahren
Dies ist eine Zusatzinformation
Chemische Verfahren finden bei Bedarf als dritte Stufe statt. Sie bedienen sich chemischer Reaktionen wie Oxidation und Fällung[3]. Sie dienen in der kommunalen Abwasserreinigung vor allem der Entfernung von Phosphor durch Fällungsreaktionen. Dieser Prozess hat große Bedeutung zur Vermeidung der Eutrophierung[4] der Gewässer. Zudem werden chemische Verfahren zur Fällung in der Industriewasserwirtschaft und zur weitergehenden Abwasserreinigung (beispielsweise Flockung/Fällung/Filtration) eingesetzt.
Dalton's Atomhypothese
John Dalton, geboren am 6. September 1766 in Eaglesfield, England, war ein englischer Naturwissenschaftler und Lehrer. Sein Vater war als Weber reich genug, seinen Sohn auf eine Schule zu schicken. Für die damalige Zeit keine Selbstverständlichkeit. Schon im Alter von 12 Jahren wurde er selbst an dieser Schule als Lehrer tätig. Im Alter von 15 Jahren (also 1781) begann er im benachbarten Kendal mit seinem Bruder und seinem Cousin eine neue Schule zu leiten. 12 Jahre später (1793) wird er an das „New College“ nach Manchester berufen, wo er Studenten unterrichtete. Er starb am 27.7.1844, im Alter von 78 Jahren in Manchester.
Sein Interesse galt vielen Dingen, vor allem aber den Vorgängen der Natur. Durch seine meteorologischen Beobachtungen vermutete er schon 1787, dass Regen durch ein Sinken der Atmosphärentemperatur entsteht. Weiterhin arbeitete er auf dem Gebiet der Wärmeausdehnung von Gasen und formulierte ein Gesetz dazu (das „Dalton-Gesetz der Partialdrücke“). John Dalton entdeckte auch die Farbenblindheit, an der er selbst litt. Seine wichtigste Theorie veröffentlichte er 1803 zu den chemischen Elementen. Er vermutet, dass alle Stoffe aus Atomen bestehen. Diese neue Theorie wurde nach ihm „Dalton’sche Atomhypothese“ benannt:
- Materie besteht aus extrem kleinen, bei Reaktion ungeteilt bleibenden Teilchen, den Atomen.
- Die Masse der Atome eines bestimmten Elements sind gleich (alle Atome eines Elements sind gleich). Die Atome verschiedener Elemente unterscheiden sich in ihren Eigenschaften (zum Beispiel in Größe, Masse, usw.).
- Es existieren so viele Atomsorten wie Elemente.
- Bei chemischen Reaktionen werden Atome in neuer Kombination vereinigt oder voneinander getrennt.
- Eine bestimmte Verbindung wird von den Atomen der betreffenden Elemente in einem bestimmten, einfachen Zahlenverhältnis gebildet.
Sein bedeutendster Beitrag dürfte sein 1808 veröffentlichtes Buch „A New System Of Chemical Philosophy“ sein. Darin schlug Dalton vor, das Atomgewicht der Elemente auf das leichteste Element, den Wasserstoff zu beziehen. Diesem ordnete er dabei die Masse 1u zu. (u steht für „unit“ = Einheit). Seine Messungen waren für die damalige Zeit und die zur Verfügung stehenden Messgeräte erstaunlich genau! Er stelle gleichzeitig eine Tabelle der Atomgewichte auf, in der die Atome nach steigender Masse angeordnet waren. Diese waren eine wichtige Vorlage für die spätere Aufstellung des Periodensystems der Elemente.
1822 wurde er Mitglied der Englischen Royal Society. Von dieser erhielt er als erster die Goldmedaille für seine Verdienste auf dem Gebiet der Chemie. 1830 wählte man ihn als erstes ausländisches Mitglied in die französische „Académie Des Sciences“ in Paris. Letzteres war die höchste Ehrung, die einem englischen Wissenschaftler im 19. Jahrhundert verliehen wurde.
Aufgaben
- Lies den gesamten Text und unterstreiche anschließend mit einem Bleistift alle Schlüsselwörter mit einer Wellenlinie, alle Nebeninformationen mit einer geraden Linie.
- Lies den Text nochmals durch. Wenn Du keine Änderungen mehr an Deinen Schlüsselwörtern und den Nebeninformationen hast, kennzeichne die Schlüsselwörter mit einem Textmarker und unterstreiche die Nebeninformationen mit einer feinen roten Linie.
- Erstelle einen Spickzettel mit den 12 wichtigsten Schlüsselwörtern (und Zeichnungen/ Skizzen wenn Du möchtest)
Fragen
- Was ist ein Atom?
- Wie verhält es sich?
- Wie kann man damit festen, flüssigen und gasförmigen Aggregatzustand erklären?
- Warum verteilen sich Stoffe im Raum / in Flüssigkeiten von selbst?
- Erkläre die Begriffe „Vereinigung „ und „Zersetzung“ mit Hilfe der Atomhypothese von Dalton.
- Was ist eine Verbindung (am Beispiel von FeS)?
Wasserstoff
Wasserstoff ist das chemisches Element mit dem Symbol H (leitet sich vom lateinischen hydrogenium ab). Man unterscheidet zwischen dem Element Wasserstoff „H“ und dem molekularen Wasserstoff „H2“. Nur diese zweite Form kommt in der Natur auch tatsächlich vor. Wasserstoff ist mit nur einem Proton und einem Elektron das leichteste der chemischen Elemente. Wasserstoff ist das leichteste aller Elemente (1,0079 u ). Der Schmelzpunkt liegt bei -262°C, der Siedepunkt bei -253°C.
Molekularer Wasserstoff H2 ist bei normaler Temperatur ein geruchloses und farbloses Gas, etwa 14-mal leichter als Luft. Sein Diffusionsvermögen und seine Wärmeleitfähigkeit sind die höchsten aller Gase und führen zu einer Reihe von technischen Problemen beim Umgang mit Wasserstoff. Wasserstoff kann z. B. durch Stahl hindurch diffundieren und somit nur schwer aufbewahrt werden. Auf diesem Gebiet wird allerdings viel geforscht, da man hofft, dass Wasserstoff das Benzin als Treibstoff für Autos ersetzen kann.
Entdeckt wurde Wasserstoff vom englischen Chemiker Henry Cavendish im Jahre 1766. Benannt wurde er von Antoine Lavoisier im Jahr 1787. Der Franzose taufte den Wasserstoff als hydro-gène (hydro = Wasser, griechisch; genes = erzeugend). Das Wort bedeutet demnach: „Wasser-Bildner“. Die deutsche Bezeichnung lässt auf die gleiche Begriffsherkunft schließen.
Durch die Zersetzung von Wasser kann man Wasserstoff leicht herstellen (Siehe Versuch mit dem Dreischenkelgerät).
Wasserstoff ist das häufigste chemische Element im Weltall. Wasserstoff macht 75% der gesamten Masse beziehungsweise 90% aller Atome im Universum aus. Sterne bestehen hauptsächlich aus Wasserstoff-Plasma. Die Verschmelzung (=Kernfusion) von Wasserstoffatomen zu Helium in Sternen bildet deren Energiequelle und ist vielleicht die größte Energiequelle überhaupt. Diese Reaktion wird vom Menschen in der Wasserstoffbombe und in experimentellen Fusionsreaktoren genutzt. Wenn man diese Reaktion kontrollieren könnte, wären alle Energieprobleme der Menschheit gelöst.
Auf der Erde sind von keinem anderen Element so viele Verbindungen bekannt. Hier kommt es meist gebunden in Form von Wasser vor, aber auch in allen Lebewesen, in Erdöl, Erdgas und in Mineralen. In der Atmosphäre der Erde kommt es aber fast gar nicht elementar vor; der überwiegende Teil des Wasserstoffs auf der Erde ist in Wasser - an Sauerstoff gebunden - vorhanden. Andere natürliche Vorkommen sind Kohle und natürliche Gase, beispielsweise Methan (CH4).
Die wichtigste Reaktion ist die Knallgasreaktion:
| 2 H2 | + | O2 | 2H2O | + | Energie |
Knallgas ist eine explosionsfähige Mischung von Wasserstoff und Sauerstoff im Verhältnis H:O=2:1. Beim Kontakt mit offenem Feuer (Glut oder Funken) erfolgt die so genannte Knallgasreaktion. Die Knallgasreaktion ist die explosionsartige Reaktion von Wasserstoff mit Sauerstoff. Sie ist eine Form der Verbrennung.
Wasserstoff lässt sich durch die Knallgasprobe nachweisen. Dabei entzündet man eine kleine Menge Wasserstoff in einem Reagenzglas. Wenn danach ein dumpfer Knall, ein Pfeifen oder ein Bellen zu hören ist, so ist der Nachweis positiv (das heißt es war Wasserstoff in dem Reagenzglas).
Gewinnung
- durch die Reaktion verdünnter Säuren mit unedlen Metallen (z. B. Zink),
- durch Elektrolyse von Wasser, Natronlauge oder wässrigen Natriumchlorid-Lösungen
- durch Zersetzung des Wassers durch Alkalimetalle
- durch chemische Reaktion (Reformierung) von Erdgas und anderen Kohlenwasserstoffen mit Wasserdampf Dampfreformierung
Wiederholungsaufgaben
- Warum blubbert kochendes Wasser?
- Kann man aus sprudelndem Mineralwasser eigentlich einen Tee kochen, der normal schmeckt? Erkläre an diesem Beispiel das Lösen von Gasen in Wasser.
- Welches Gas ist eigentlich in Mineralwasser aufgelöst?
- Warum trocknet eine gewischte Tafel eigentlich, sie ist doch kälter als der Siedepunkt von Wasser?
- Wie kann es in einem heißem Sommer passieren, dass die Fische in kleineren Seen sterben? In welchen Jahreszeiten fühlen sich Fische demzufolge am wohlsten?
- Beschreibe, was man beobachtet und was mit den Atomen passiert, wenn man Wasser kocht.
- Nenne drei Lösungsmittel und ordne ihnen Stoffe zu, die sich darin auflösen.
- Warum kann sich Salz nicht in Waschbenzin auflösen. Welche Stoffe löst Waschbenzin besser? Nenne eine passende Regel.
- In welcher Lösungsmittelgruppe lösen sich: Säuren, Laugen, Salze, Nagellack, Butter, Ölflecken.
- Ein starker Raucher hat gelbe Finger und Zähne und in der Wohnung gelb-verschmutzte Gardinen. Nur mit Wasser bekommt er es nicht sauber. Was ist für die Verschmutzung verantwortlich und wie kann dem Raucher geholfen werden?
- Erkläre, wie man eine übersättigte Salzlösung herstellen und wie man mit dieser einen Kristall züchten kann.
- Beim Kochen einer gefrorenen Salzlösung kann man zwei interessante Beobachtungen machen. Erkläre sie.
- Erkläre die Wirkung von Streusalz.
- Warum wird in die Scheibenwaschanlage (im Winter) Alkohol zum Seifenwasser zugefügt?
- Warum gefriert eine mit Alkohol enteiste Autoscheibe schneller wieder, als eine, die freigekratzt wurde?
- Warum wird stark verschmutze Wäsche bei 60°C und leicht verschmutzte Wäsche nur bei 40°C gewaschen?
- Nenne zwei Methoden, wie man fettige Hände nach dem Essen eines Hähnchens reinigen kann.
- Ein Schüler hatte einen Motorschaden mit seinem Mofa. Er vermutet, dass ihm jemand Zucker in den Tank getan hat.
- a) Warum ist Zucker für den Motor gefährlich und wie wirkt er sich aus?
- b) Kann man den Zucker noch nachweisen - und wie?
- Warum schwimmen die Fettaugen in der Suppe oben?
- Beschreibe die chemische Verbindung H2O. Nenne Vorkommen, Eigenschaften und Bedeutung.
- Wie erklärst Du Dir den hohen Wasserverbrauch in Deutschland von bis zu 300 L pro Tag und Person? (zum Vergleich: in einigen Entwicklungsländern liegt er bei 4 L pro Tag und Person!)
- Wie stellt man aus Wasser eigentlich Wasserstoff her? Kann man das auch „kostenlos“ machen?
- Beschreibe Wasserstoff mit seinen Eigenschaften und Reaktionen.
- Nenne chemische Trennungsmethoden und ordne ihnen passende Stoffgemische zu.
- Wie funktioniert eigentlich eine Kläranlage?
- Beschreibe die Extraktion von Erdnussöl.
- Wie trennt man ein Sand-Salzgemisch?
- Vervollständige die allgemeinen Aussagen eines Diagramms:
- Je ................ die Gerade, desto höher die Geschwindigkeit. Unterbrechungen hingegen sagen etwas über den .................................... aus. ................... die Kurve , wie gewohnt, danach weiter, so liegt ein ................................ vor, entsteht eine Stufe, so war vielleicht der ..................... aus. Fällt die .................................. , so wurde vielleicht kälteres Wasser zugefügt.
- Welche Messfehler kann man beim Messen einer Temperatur-Zeitkurve erhalten? Zähle sie auf.


